カルボン酸
カルボン酸の性質
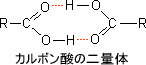
カルボン酸はカルボキシル基を含んでおり、R-COOHで表される。また、ほとんどのカルボン酸は同じ程度の分子量のアルコールよりも沸点が高い。これは、多くのカルボン酸が水素結合して二量体を形成するためである。
・カルボン酸の酸性度
下に安息香酸、p-ヒドロキシ安息香酸、p-ニトロ安息香酸の構造式を示す。

「この三つの化合物を酸性度の高い順に並べよ」と聞かれたら少し戸惑うかもしれないが、共鳴式を書けばこの問いに答えることができる。下にそれぞれの共鳴式を示す。
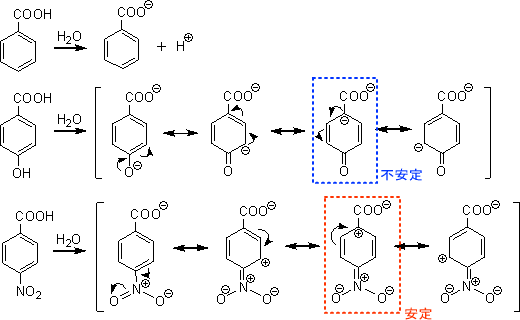
「酸性が強いということは、イオンの形がより安定である」ということができる。つまり、イオン形のときの安定性が高ければ高いほど酸性が強くなる。
p-ヒドロキシ安息香酸の共鳴式で青色で囲んだ部分では、カルボキシラートイオンの隣の炭素が負電荷をもつことになる。カルボキシラートイオンも負電荷をもつので、互いに反発して不安定となる。
それに対し、p-ニトロ安息香酸の共鳴式で赤色で囲んだ部分では、カルボキシラートイオンの隣の炭素が正電荷をもつことになる。この正電荷がカルボキシラートイオンの負電荷を分散させるため安定化する。
つまり、「p-ニトロ安息香酸>安息香酸>p-ヒドロキシ安息香酸」の順で酸性が強い。
カルボン酸の反応
・エステルの合成
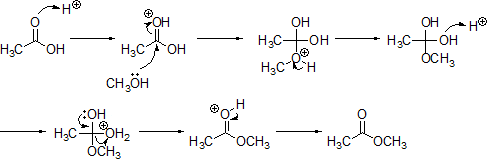
カルボン酸とアルコールを酸触媒存在下で加熱させるとエステルを生成することができる。この反応はFischerが発見したのでFischerのエステル化という。

下にCH3COOHとCH3OHを用いてFischerのエステル合成のメカニズムを示す。
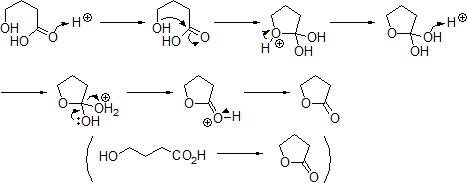
もし分子内にアルコールとカルボン酸があるなら、環状エステルであるラクトンを生成することがある。
エステルの生成には、このような縮合反応による方法以外にも合成方法がある。第一級ハロアルカンとカルボキシラートイオンを反応させれば、エステルを生成することができる。なお、この反応はSN2反応で進行する。
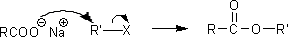
・還元
カルボン酸は還元しにくい化合物である。しかし、LiAlH4(テトラヒドリドアルミン酸リチウム)などの強力な還元剤と反応させると第一級アルコールを得ることができる。
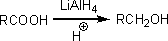
・酸ハロゲン化物の生成
カルボキシル基をもつ化合物とSOCl2(塩化チオニル)を反応させると、酸ハロゲン化物を生成することができる。ただし、SOCl2(塩化チオニル)の他にPOCl3(塩化ホスホリル)、PCl5(五酸化リン)、ClCOCOCl(塩化オキサリル)などでも可能である。
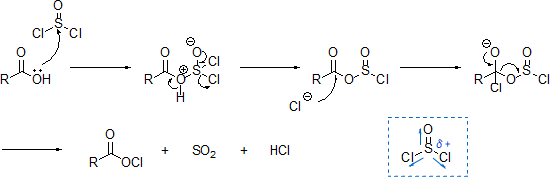
この酸ハロゲン化物はさまざまな反応に利用することができる。例えば、アンモニア (or 第一級アミン、第二級アミン)と反応させればアミドを生成し、アルコールと反応させればエステルを生成する。
下に酸ハロゲン化物と反応してアミン、エステル、酸無水物、第一級アルコール、アルデヒド、カルボン酸が生成する反応を示す。
(1)アミド
アミドは酸ハロゲン化物とアンモニア、第一級アミン、第二級アミンと反応させると生成する。ただし、第三級アミンでは反応が起こらない。
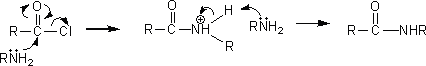
アミドを生成させるには、この方法以外にもカルボン酸から生成させる方法や酸無水物から生成させる方法がある。ただし、カルボン酸からよりも酸ハロゲン化物や酸無水物を用いてアミドを生成させるほうが効率が良い。
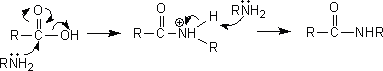
また、分子内にアミノ基とカルボキシル基があり環状になったときにひずみが生じないなら、加熱すると環状のアミノであるラクタムを得ることができる。

(2)エステル
酸ハロゲン化物とアルコールを反応させるとエステルを生成する。
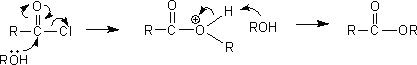
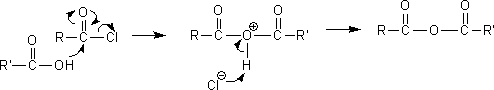
(3)酸無水物
酸ハロゲン化物とカルボン酸(or カルボキシラートイオン)と反応させると酸無水物を得ることができる。
酸無水物は酸ハロゲン化物より反応性は劣るが、酸ハロゲン化物と同じように求核試薬と反応する。つまり、アンモニアと反応するとアミドを生成し、アルコールと反応させればエステルを生成する。
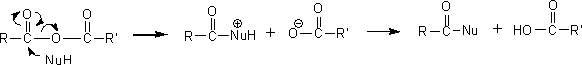
ただし、酸無水物から酸ハロゲン化物を生成することはできない。
(4)還元反応(第一級アルコール、アルデヒド)
酸ハロゲン化物をLiAlH4(テトラヒドリドアルミン酸リチウム)と反応させて還元すると、第一級アルコールを得ることができる。
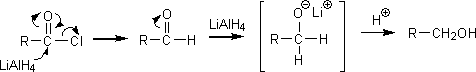
また、酸ハロゲン化物をPd/BaSO4触媒存在下で水素と接触還元させるとアルデヒドを生成する。
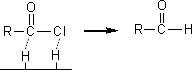
(5)カルボン酸
酸ハロゲン化物と水を反応させるとカルボン酸を生成する。
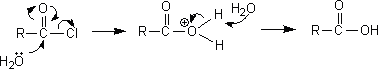
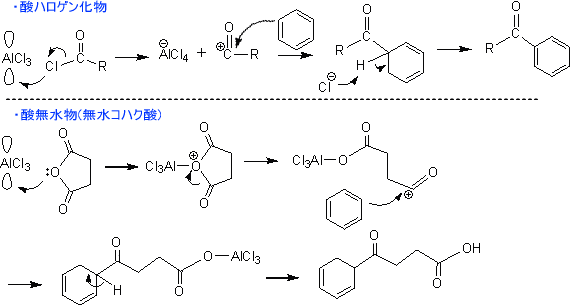
・フリーデル・クラフツ反応
フリーデル・クラフツ反応は「芳香族化合物の反応性」でも述べた。この反応は酸ハロゲン化物や酸無水物とベンゼンなどを反応させ、芳香族ケトンを合成するのに利用されている。
α位の炭素に結合している水素の置換
カルボン酸やエステルがある場合、α位の炭素に結合している水素を置換することができる。こ
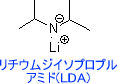
れによって、α位の炭素にハロゲンやアルキル基を導入することができる。
α炭素から水素を引き抜く強塩基にはリチウムジイソプロピルアミド(LDA)が主に使用されている。これはLDAの求核性が弱いからである。求核性が弱い理由は立体障害が生じるためである。
エステルの場合は強塩基1molで十分であるが、カルボン酸では強塩基2mol分必要である。カルボン酸の場合、最初にカルボキシル基のプロトンを引き抜いた後でα炭素の水素を引き抜くからである。
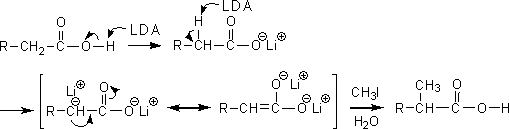
「α位の置換ができるならβ位やγ位の置換はできないか」という疑問であるが、これは無理である。なぜなら、α位の置換のときだけα炭素の水素を引き抜いたときに上のような共鳴式を書くことができるからである。
つまり、α位でないと安定化しないためβ位やγ位では置換が起こらない。
スポンサードリンク
カテゴリー
スポンサードリンク
