芳香族化合物の反応性
芳香族求電子置換反応
ベンゼンは6個のπ電子が非局在化(電子が分散して存在)している。ベンゼンは電子を与える「電子供与体」として働き、カチオンや電子が欠如した物質(求電子試薬)と反応する。
この反応を利用することでベンゼンに導入することのできる官能基はハロゲン(フッ素を除く)、ニトロ基(-NO2)、アルキル基(-R)、アシル基(-COR)、スルホ基(-SO3H)などである。
ハロゲン化
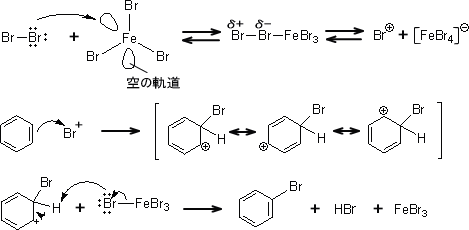
ここでは例として臭素化を説明する。
ベンゼンと臭素の反応は、触媒がないときわめて速度が遅い。 しかし、ルイス酸触媒である「FeBr3」を加えると反応が速くなる。これは、求電子試薬である臭素カチオン(Br )が発生する効率が良くなるからである。
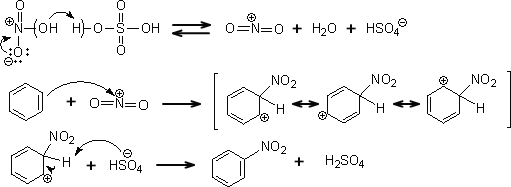
ニトロ化
濃硫酸と濃硝酸を混ぜてベンゼンと反応させると、ニトロベンゼンを得ることができる。このとき、濃硫酸は触媒として働く。
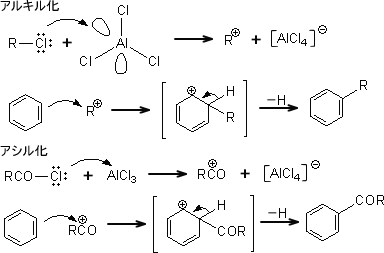
アルキル化とアシル化
ベンゼンにアルキル基やアシル基を導入する方法に、フリーデル・クラフツ反応(Friedel-Crafts reaction)がある。これはハロアルカン(RCl)やハロゲン化アシル(RCOCl)にルイス酸触媒である「AlCl3」を作用させて、求電子試薬であるアルキルカチオン(R )やアシルカチオン(RCO )を生成する方法である。
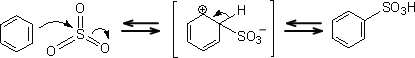
スルホン化
ベンゼンに三酸化硫黄と硫酸の混合物を反応させると、ベンゼンスルホン酸を生成することができる。このときの求電子試薬はHSO3 である。
配向性
ベンゼンに第二の置換基を導入するとき、場所の候補としてオルト、メタ、パラの位置がある。そして、第二の置換基がどの位置に付加しやすいかは、最初の置換基の種類によって決まる。
・オルト・パラ配向性置換基
アニソールがニトロ化するとき、次のような共鳴式を書くことができる。
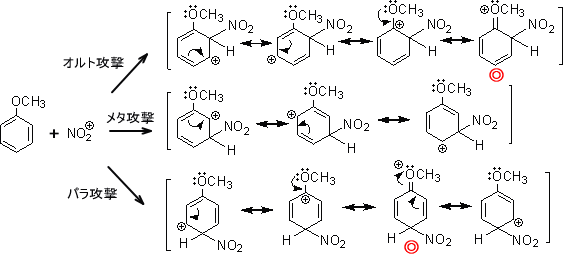
この共鳴式を見ると、正電荷をもつ炭素の構造はオクテット則を満たしていない(炭素上に電子が6個しかない)。しかし、◎で印をつけた構造では全ての原子がオクテット則を満たしている。
つまりこれらの構造のうち、◎の構造だけがオクテット則を満たしているため特に安定となる。物質は安定な方向へ進むので、共鳴構造式の中に◎の構造をもつ物質を生成するように進行する。つまり、オルト位とパラ位に付加するように反応が進む。
なお、この反応は求電子試薬に関係なくオルト位とパラ位が優先的に起こる。このような置換基をオルト・パラ配向性置換基と呼ぶ。この置換基には-OH、-OR、-OCOR、-NH2、-NR2、-NHCOR、ハロゲンがある。
また、メチル基やアルキル基もオルト・パラ配向性置換基である。これは共鳴構造式を書いたときに、そのうちの一つが第三級カルボカチオンであるため安定となる。
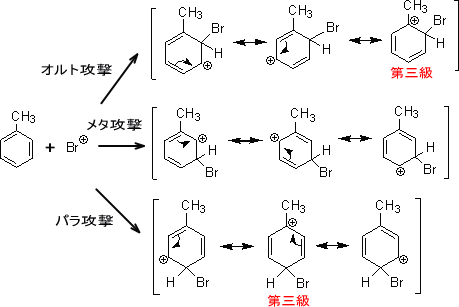
上の共鳴式を見ると、ほとんどの構造が第二級カルボカチオンを生じている。しかし、オルト位とパラ位を見ると一ヶ所だけ第三級カルボカチオンが生じている。第二級カルボカチオンよりも第三級カルボカチオンの方が安定なので、オルト位とパラ位に優先的に付加する。
・メタ配向性置換基
ニトロベンゼンがニトロ化する場合、メタ位が優先的に反応する。そのときの共鳴構造式は次のようになっている。
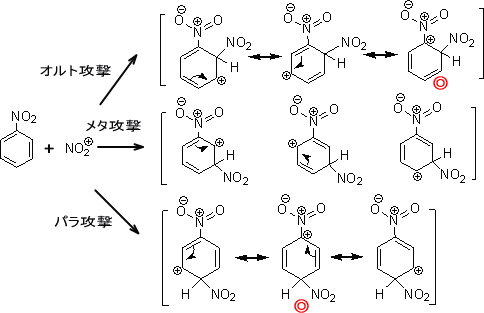
オルト攻撃とパラ攻撃を見ると、◎の構造では正電荷をもつ原子がお互いに隣り合う共鳴式を書くことができ、エネルギー的に不利になっている。
しかしメタ位では正電荷が隣り合うことはなく、エネルギー的に不利な構造を避けることができる。そのため、ニトロベンゼンの求電子試薬はメタ位に優先的に付加する。
このような置換基をメタ配向性置換基と呼ぶ。この置換基には-CHO、-COOR、-COOH、-COR、-SO3H、-CN、-NO2などがある。
ベンザインを経由する反応
p-クロロトルエンは液体アンモニア中でナトリウムアミドと反応すると、m-トルイジンまたはp-トルイジンを生成する。
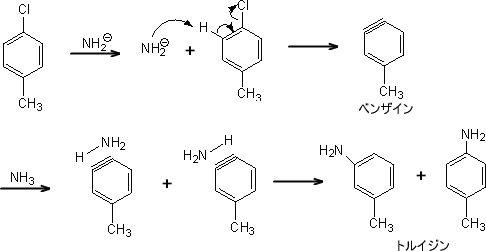
この反応はまずHとClが脱離し、中間体として不安定なベンザインを得る。このベンザインにアンモニアが付加することで、トルイジンを得ることができる。
ベンゼンジアゾニウム塩
ベンゼンジアゾニウムを合成する場合、アニリンに亜硝酸と塩酸(硫酸)を反応させればよい。ただし、芳香族アミンのジアゾニウム塩は0℃付近で安定であり、温度を上げると分解してしまう。そのため、冷やしながら反応させないといけない。
ジアゾニウム基に求核試薬を反応させると置換反応が起こる。例えば、ジアゾニウム塩に銅塩(CuCl、CuBr、CuCN)を反応させるとハロゲン、シアノ基を導入することができる。ただし、ヨウ素を導入するときはヨウ化銅(CuI)を用いなくても、ヨウ化カリウム(KI)でも反応する。
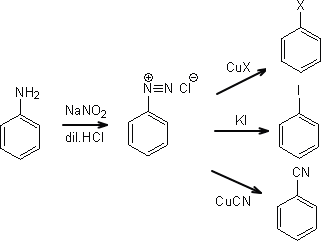
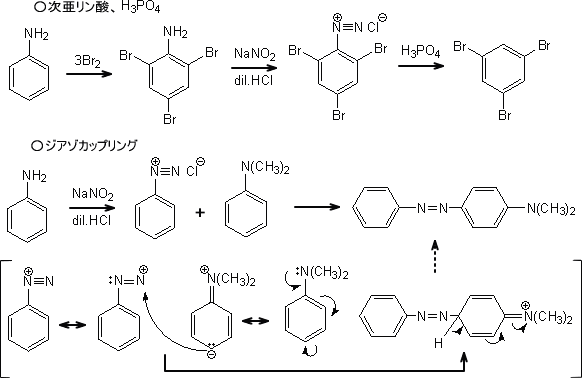
ジアゾニウム塩ではこの他にも次亜リン酸での還元やジアゾカップリングなどの反応がある。
スポンサードリンク
カテゴリー
スポンサードリンク
