pHの計算(多塩基酸、両性物質)
多塩基酸・多酸塩基溶液・両性物質
(1)多塩基酸
ここでは二塩基酸である炭酸(H2CO3)を考える。1.0×10-2mol/LのH2CO3水溶液のpHとCO32-イオン濃度を求める。
H2CO3の電離定数をそれぞれKa1=4.6×10-7、Ka2=4.4×10-11とすると平衡は次のように表せられる。
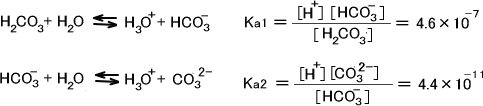
弱酸・弱塩基酸溶液のpHの計算で紹介したやり方と同じように計算する。
[H+] = 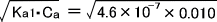 = 6.8×10-5(mol/L) ∴pH=4.17
= 6.8×10-5(mol/L) ∴pH=4.17
ここでは[H+] >> [OH-] 、 Ca >> [H+]である。
次にCO32-イオン濃度を求める。第二段階の電離によって生じるH+は、第一段階の電離によって生じるH+に比べ非常に少ない。
つまり第二段階で生じるH+を無視することができ、[H+] ≒ [HCO3-]とすることができる。よって、第二段階によって生じるCO32-イオン濃度は次のように求めることができる。
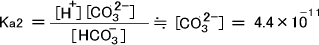
(2)多酸塩基
次はCO32-水溶液(Na2CO32-水溶液)を考える。1.0×10-1mol/LのNa2CO32-水溶液のpHを求める。
H2CO3の電離定数をそれぞれKa1=4.6×10-7、Ka2=4.4×10-11とする。CO32-の第一段階の電離定数をKb1とすると平衡は次のように表せれる。
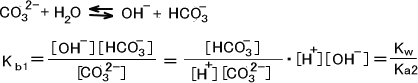
第二段階の電離を無視して計算すると次のようになる。
[OH-] =  = 4.8×10-3(mol/L)
= 4.8×10-3(mol/L)
∴pOH = 2.32 pH = 14 - 2.32 = 11.68
(3)両性物質
両性物質とは酸にも塩基にもなり得ることがある物質である。HCO3-はCO3-に対しては酸であるが、H2CO3に対しては塩基である。
ここで、1.0×10-1mol/LのNaHCO32-水溶液のpHを考える。この水溶液では次の3種類の平衡が考えられる。
H2CO3の電離定数をそれぞれKa1=4.6×10-7、Ka2=4.4×10-11とする。CO32-の電離定数をそれぞれKb1、Kb2とすると平衡は次のように表せられる。
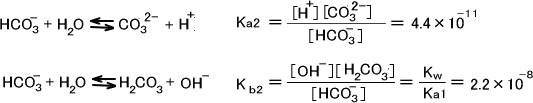
同じ化学種同士で酸塩基反応が起こる(不均化反応)。この平衡定数をKとする。
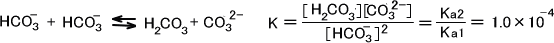
この3種の平衡定数Ka2、Kb2、Kを比較すると右へ進む反応は不均化反応が最もよく進む。つまり不均化反応によって生成するH2CO3、CO32-の量は他の2種の反応によって生成するH2CO3、CO32-の量よりも非常に大きいということができ、他の2種の反応を無視できる。
生成するH2CO3、CO32-はほとんどが不均化反応によるものと考えると[H2CO3] ≒ [CO32-]となる。
ここで、H2CO3の二つの電離定数Ka1、Ka2をかける。
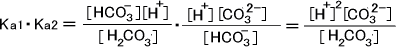
[H2CO3] ≒ [CO32-]なので[H+]2 ≒ Ka1・Ka2となる。
これを計算すると[H+] = 4.5×10-9 、pH = 8.3となる。
スポンサードリンク
カテゴリー
スポンサードリンク
