重量分析、定量分析
溶解度積
溶解度積とは飽和溶液におけるイオン積のことである。これは一定の温度、イオン強度で一定の値である。
溶媒中に存在する各イオンのイオン積が溶解度積と等しくなると飽和溶液となる。もし、イオン積が溶解度積を超えるとその分だけ沈殿する。
ここで難溶性電解質の溶解度積を考える。
ある温度において溶解度がCs(mol/L)である難溶性電解質 MXの溶解度積Ksは次のように表される。
MX 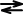 M++X-
M++X-
濃度 Cs Cs
Ks = [M+][X-] = Ca・Ca = Ca2
難溶性電解質 MX2の場合
MX2 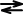 M++X2-
M++X2-
濃度 Cs 2×Cs
Ks = [M+][X-]2 = Ca・(2×Ca)2 = 4Ca2
難溶性電解質 AmBnの場合
AmBn 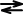 mAn++nBm-
mAn++nBm-
濃度 m×Cs n×Cs
従って、溶解度積と溶解度には次のような関係がある。
Ks = [An+]m[Bm-]n = (m×Ca)m・(n×Ca)n = mmnnCsm+n
重量分析法
特定のイオンを沈殿試薬によって沈殿させるとき、そのときの沈殿した形を沈殿形という。また、特定のイオンの重さを量るときの形を秤量形という。
例えばAg+の沈殿形と秤量形の形はAgClと同じであり、Al3+の沈殿形はAl(OH)3であるが秤量形はAl2O3である。
また、秤量形の重さからもとの化合物の量を計算するための係数を換算係数という。
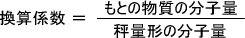
定量分析法
滴定を行うとき、濃度未知の溶液に含まれる目的物質の濃度を正確に決定するために溶液を滴下していく。このとき指示薬によって色により終点を知らせてくれる。
この未知溶液の濃度を正確に決定する溶液を標準液といい、標準液の正確な濃度を知るための操作を評定という。評定を行うときに使用する正確な基準物質を一次標準物質という。
また、標準液の滴定によって目的物質の濃度を知る操作を定量分析法という。
定量分析法には1.中和滴定 2.非水滴定 3.沈殿滴定 4.キレート滴定 5.酸化還元滴定 などがある。
ファクター
標準液を作るときに最初から正確な濃度を作ることは困難である。例えば0.10mol/Lの過マンガン酸カリウムを作るときは大まかな量でよい。これは後でシュウ酸(一次標準物質)によって、作った過マンガン酸カリウムの濃度を知ることができるからである。
正確な濃度を知ることができたら、今度はその正確な濃度を表さないといけない。過マンガン酸カリウムの表示ラベルに「0.10mol/L KMnO4, f=1.020」と記入されていたら、その過マンガン酸カリウムの正確な濃度は0.102mol/Lである。
このfがファクターである。ファクターfの範囲はf=0.970~1.030の範囲にあるように標準液を調節しなければならない。
ファクターの求め方は次のとおりである。まず最初に同じモル数(a、b)で反応するときのファクターを求める。
aA+bB → cC+dD
a、b、c、d:モル数 A:標準物質(ここではシュウ酸)
B:標準液(ここでは過マンガン酸カリウム) C、D:反応生成物
この場合次のようにファクターを求める。
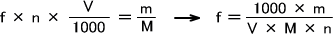
n:標準液の表示モル濃度(mol/L) V:滴定で消費した標準液の容量(ml)
m:標準物質の採取量(g) M:標準物質の分子量(g)
しかし、実際には過マンガン酸カリウムとシュウ酸では反応するモル濃度が等しくない。そのときは次の式で求める。
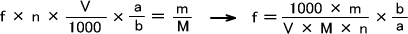
1.中和滴定
酸と塩基の反応を利用する滴定である。酸や塩基の濃度によってpHが変化する。特に当量点付近では急激なpHの変化が見られる。このpHの変化を色で示すのが酸塩基指示薬である。
酸塩基指示薬はそれ自体が弱酸、弱塩基または両性である。pHが変化するということはプロトンの濃度が変化するということである。このプロトンの濃度によって構造が変わり、色が変化するために終点を判断できる。
2.非水滴定
弱酸や弱塩基では明瞭なpHジャンプが見られないため、中和滴定によって定量分析することはできない。しかし水以外の溶媒を使用すると弱酸が強酸として、弱塩基が強塩基としてふるまうことがある。この状態なら中和滴定のような滴定が可能となる。
カールフィッシャー法
この方法はカールフィッシャー試液を用いる滴定である。カールフィッシャー試液はピリジン(などの有機溶媒)、メタノール(などの低級アルコール)、ヨウ素、二酸化硫黄を含む。
これは水を滴定する水分定量法である。これには非水溶媒中での酸化還元反応を利用する。このとき水はヨウ素。二酸化硫黄と定量的に反応する。
I2+SO2+3RN+CH3OH+H2O → 2RN+HI-+RN+H-OSO2OCH3
3.沈殿滴定
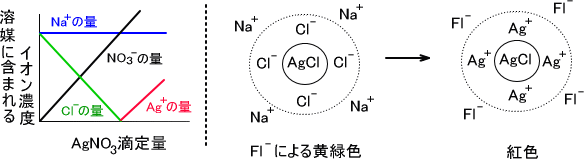
Fajans法
コロイド粒子は構成成分であるイオンを吸着する性質がある。さらに吸着したイオンは反対の電荷をもつイオンを弱く吸着する。これにより電気的二重層を形成する。
コロイド粒子は過剰量のイオンを強く引き付けるが、当量点を過ぎるとコロイドが吸着するイオンの電荷が逆転する。イオンの吸着の仕方が変化するため終点を判断できる。
例えばNaClにAgNO3を滴定する。このときコロイドとしてAgClができ、構成成分であるAg+とCl-と比べると最初はCl-の方が量が多い。そのためコロイド粒子はCl-を引き付けてそのまわりにNa+が存在する形となる。
AgNO3をそのまま滴定していくと今度はCl-よりもAg+の方が過剰となる。そうなるとコロイドはAg+を吸着するようになる。ここにフルオレセインが存在するとAg+のまわりをフルオレセイン(Fl-)が取り囲む形となる。このとき紅色に変化する。
4.キレート滴定
「金属錯体」を参照
5.酸化還元滴定
電子の受け渡しを利用する滴定法である。酸化とは電子を失う反応であり、還元とは電子を得る反応である。
酸化剤として過マンガン酸カリウムやヨウ素がよく使用される。過マンガン酸カリウムはそれ自体が赤紫色なので指示薬を必要としない。ヨウ素はたとえ微量存在してもデンプンによって青色となる。
スポンサードリンク
カテゴリー
スポンサードリンク
