錯体化学
金属錯体
Cu2 やNi2 などの水溶液は美しい色をしている。この溶液にいろいろな化学物質を混ぜるとあるときは色が変化し、あるときは沈殿を生じることもある。
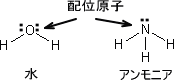
アンモニアは陽イオンと配位結合することができる。これは非共有電子対を利用する。このとき陽イオンが金属イオンであればその配位化合物を金属錯体と呼び、そのイオンを錯イオンと呼ぶ。
また、金属イオンと配位結合するイオンや分子を配位子という。配位子を構成する原子の中でも貴族イオンと直接結合する原子を特に配位原子という。配位原子には酸素、イオウ、窒素、ハロゲンなどがある。
例えば水(H2O)は配位子であるが、具体的に非共有電子対をもつのは酸素分子である。つまり、水の場合は酸素原子が配位原子である。同じように配位子であるアンモニアでは窒素が配位原子となる。
反応速度と置換反応
金属イオンは溶液中で必ず錯体を形成している。水溶液中での錯体生成反応は次のような配位子置換反応である。
M-X Y → X M-Y
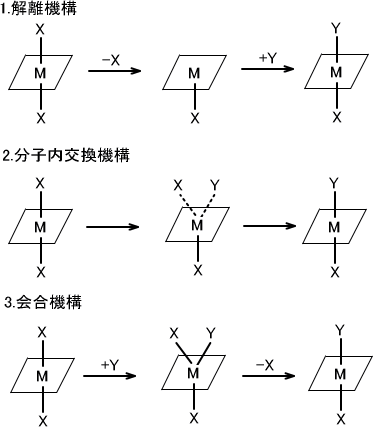
この置換反応には3種類の反応機構がある。
(1)解離機構
この反応ではまずM-X結合が切れることから始まる。M-X結合が切れるので中間体は配位子が一つ減少した形となる。そこに素早く配位子Yと結合し、反応を完了する。
この機構の反応速度はM-X結合が切れる速度によって決まる。つまり反応速度は配位子Xの種類によるもので、配位子Yは関係がない。
(2)分子内交換機構
この反応ではM-X結合がゆるくなると同時にM-Y結合を形成し始める。そのため中間体での配位子の増加や減少がない。中間体はX・・M・・Yと表される。
(3)会合機構
この反応ではM-X結合している場所にM-Y結合を形成する。中間体はX-M-Yと表される。そのため中間対の配位子は一つ増加している。X-M-Yの形成によりM-Xが切れやすくなるため、M-Y結合を形成する。
反応速度はX-M-Yが形成する速度による。つまり反応速度は配位子Yの種類によって決定し、配意子Xの種類には関与しない。
HSAB則
錯体生成反応によって金属イオンの分析を行うとする。このとき、目的の金属イオンと高い親和力をもつ配位子を知ることができる一般則である。
金属イオンと配位子をそれぞれかたい酸・塩基、やわらかい酸・塩基に分ける。このときかたい酸とかたい塩基同士、やわらかい酸とやわらかい塩基同士が親和力が高い。
かたい酸の条件は「イオン半径が小さい」「正電荷が大きい」ことであり、やわらかい酸の条件は「イオン半径が大きい」「正電荷が小さい」ことである。
かたい酸:H+、Li+、Na+、K+、Mg2+、Ca2+、Cr3+、Fe3+、Co3+、Al3+
中間の酸:Fe2+、Co2+、Ni2+、Cu2+、Zn2+、Pb2+
やわらかい酸:Cu+、Ag+、Hg2+、Pd2+、Pt2+、Cd2+
かたい塩基の条件は「電気陰性度が大きい」「分極しにくい」「酸化されにくい」ことであり、やわらかい塩基の条件は「電気陰性度が小さい」「分極されやすい」「酸化されやすい」ことである。
かたい塩基:H2O、OH-、RO-、CO32-、SO42-、NH3、EDTA、F-、Cl-
中間の塩基:NO2-、Br-
やわらかい塩基:RSH、RS-、S2-、CN-、CO、PR3、I-
キレート形成
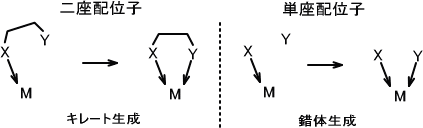
分子中に一つの配位原子が存在する場合、その配位子を単座配位子という。分子中に二つ以上の配位原子が存在する場合、その配位子を多座配位子という。多座配位子は具体的に二座配位子、三座配位子という。
キレートとはギリシャ語の「カニのはさみ」に由来している。多座配位子が金属イオンをはさむようにして錯体を形成するとき、この錯体を金属キレートまたはキレート化合物という。
キレート効果
おなじ配位原子をもつ単座配位子と二座配位子があるとする。一般的に単座配位子によって形成される錯体の安定度より、二座配位子によって形成される錯体の方が安定度が高い。この現象をキレート効果という。
二つの配位原子を分かりやすくするためにX、Yとする(実際はXとYは同じ配位原子)。いま二座配位子が金属イオンMに結合しようとする。キレートが生成するとき、二座配位子に含まれる一つの配意原子XがMに結合する。すると、もう片方の配意原子Yは比較的近くに存在するため同じ金属イオンに結合する確率は高くなる。
今度は単座配位子が金属イオンMに結合しようとする。このとき配位原子Xが金属イオンと結合したとき、配意原子Yが金属イオンMと結合する確率は相対的に低くなる。これがキレート効果が生じる理由である。
キレート滴定
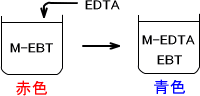
キレート滴定とは金属イオンとEDTA(エチレンジアミン四酢酸)のようなキレート試薬によって生じるキレート形成反応を利用する。終点での標準液の消費量によって溶液に含まれている金属イオンの定量を行う方法である。ここではEBT(エリオムブラックT)を例に金属指示薬の説明をする。
EBTはpH7~11付近で青色を示す。この溶液に2価、3価の金属イオンを入れると赤色に変わる。しかしMg2+、Ca2+、Zn2+などの金属イオンではEBTはEDTAよりもキレート生成定数が低いため、終点付近では容易にEDTAによって配位子交換される。
最初に金属イオンとEBTがキレートを形成して赤色を示します。そこにEDTAを入れることで金属イオンとEDTAが配位子交換されます。するとEBTが遊離するのでEBT本来の色である青色を示す。
スポンサードリンク
カテゴリー
スポンサードリンク
