分子間相互作用
双極子間相互作用
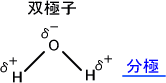
電気陰性度が異なる原子同士が結合していると、わずかであるが電荷に偏りが生じる。例えば、H-O結合では酸素原子の方が電気陰性度が高いため、酸素原子が少しマイナスの電荷を帯び、水素原子が少しプラスの電荷を帯びることになる。
電気陰性度が強いということは電子を引き付ける力が強いということである。電子はマイナスの電荷を帯びているので、電気陰性度が強い酸素原子の方がマイナスの電荷を帯びるということが理解できる。
このように正電荷と負電荷の偏りが非常に近くで存在している状態を分極といい、分極している分子を双極子という。
炭素に対して酸素、窒素、硫黄、ハロゲンは電気陰性度が高い。これらの原子が炭素と結合すると電化に偏りが生じ、電気的双極子を生じる。
マイナスの電荷とプラスの電荷をもつものは、お互いに引き寄せられる。双極子もプラス・マイナスの電荷をもっているので、対応する電荷が来ると引き寄せられてしまう。
この双極子が「イオンの電化」によって引き寄せられる場合、イオン-双極子相互作用が生まれる。また、「他の双極子」に引き寄せられる場合は双極子-双極子相互作用が生まれる。双極子の電化はイオンほど強くないのでイオン-双極子間相互作用の方が結合が強い。
分極している分子を中性分子に近づけると、中性分子に双極子が誘起される。双極子が誘起された中性分子は双極子と相互作用することになる。双極子と中性分子に誘起された双極子が引き合う相互作用を双極子-誘起双極子相互作用という。
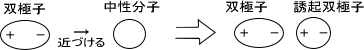
水素結合
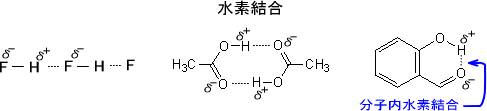
水素結合は双極子-双極子相互作用の一種である。典型的な水素結合は酸素(O)、窒素(N)、フッ素(F)などの電気陰性度が高い原子によって起こる。これらの原子の隣に結合している水素原子は正の電荷を帯びることになる。
正電荷を帯びた水素原子は他の酸素、窒素、硫黄、ハロゲン原子と強く引き合うため、相互作用しやすい。この水素結合は -X-H…Y- と表される。
水素結合は生命にとって重要である。DNAは二重らせん構造をしており、二本の鎖をつなぐのは水素結合である。水素結合は共有結合ほど結合する力が強くないため、DNAを複製するために二重らせん構造をほどくのにちょうどよい結合力である。
タンパク質はアミノ酸がペプチド結合(-CO-NH-)でつながったものである。このとき、ペプチド結合のNHとCOの部分が水素結合(-C=O…HN-)してαへリックスやβ構造を構成するのに関与している。
分散力
中性分子(無極性分子)には電荷の偏りがない。しかし電子は絶え間なく動いており、ある瞬間をとらえた時、電荷の偏りが生じるため瞬間的な双極子が誘起され分極していると見ることができる。
この瞬間的な双極子が他の分子にも双極子をもたらし相互作用をする。この瞬間双極子間で引き合う力を分散力と呼ぶ。
なお、分散力はロンドン力またはロンドンの分散力とも呼ばれる。
ファンデルワールス力
フンデルワールス力とは、中性分子間での相互作用の総称である。つまり、ファンデルワールス相互は「双極子-双極子相互作用」「双極子-誘起双極子相互作用」「分散力の引力」「電子間相互作用による反発力」を考慮しなければならない。
中性物質同士は前述の3種類の引力(双極子-双極子相互作用、双極子-誘起双極子相互作用、分散力の引力)によってお互いに引き合うが、近すぎると負の電荷を帯びている電子が反発を起こしてしまう。
お互いの分子の距離をrとすると、引力はr6に反比例し、反発力はr12に反比例することが多い。このときのファンデルワールス相互作用の引力と反発力をまとめたのがレナード-ジョーンズポテンシャルである。下にそのグラフを示す。
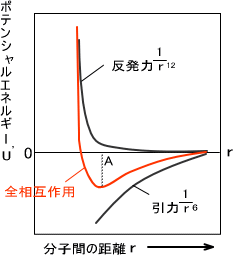
図の赤線は引力と反発力のエネルギーを足し合わせた分子のポテンシャルエネルギーである。図を見て分かるとおり、分子間の距離が近すぎるとポテンシャルエネルギーが高くなり不安定となる。(電子同士が反発を起こすため)
逆に遠すぎても相互作用がなくなるので、ポテンシャルエネルギーが高くなってしまう。
図のポテンシャルエネルギーが一番低くなるA点での分子間の距離であり、この距離で最もよく相互作用をする。ただし、極小値の位置や深さは原子や分子によって変化する。
疎水性相互作用
水中では疎水性をもつ物質は水を避けて集まろうとする。この現象はエントロピーの増大が原動力となっている。水をはじく疎水なので油は集まる方向に行く。
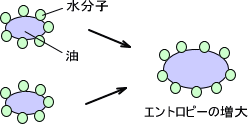
生体分子の構造形成においても疎水性相互作用は重要である。細胞や細胞器官を取り囲む脂質二重膜には、膜タンパク質による疎水性部分がある。この膜タンパク質の生体膜への結合は疎水性相互作用によるものである。
スポンサードリンク
カテゴリー
スポンサードリンク
