エンタルピー、エントロピー
熱力学には熱や仕事のエネルギーなどが相互に関係している。これらの性質は圧力、温度、体積になどの条件によって記述される。
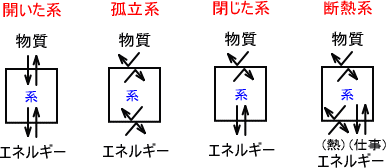
それぞれ物質の集まりを系と呼び、その他の部分を外界と呼ぶ。この「物質、エネルギー、外界」には「開いた系、孤立系、閉じた系、断熱系」の4つの系が存在する。
理想気体の状態は pV=nRT で表される。このとき圧力p、体積V、物質量n、温度Tは気体の状態が決定すると決まってくる。このように系の状態が決定することで決まる量を状態関数または状態量という。
エンタルピー
熱力学第一法則とは「孤立系ではエネルギーは形を変え、相互に変化することはあるが、新たに発生したり消えたりしない」というエネルギー保存の法則である。
系の内部エネルギー変化(⊿U)は熱量(q)と仕事量(⊿w)の変化によって決定する。
⊿U = q ⊿w
このとき系は圧力一定で体積が⊿Vの分だけ増加すると、それだけ系が外部に対して仕事をしたということになる。
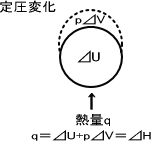
w = -p⊿V
⊿U = q - p⊿V
これを変形すると次のようになる。
q = ⊿U p⊿V
圧力一定では外界と系の圧力は等しい。この条件下でも熱量qは状態関数の変化量となる。ここで、新しい状態関数「エンタルピーH」を定義する。
H = U pV
定圧の条件下では次のように変化量⊿Hを書ける。
⊿H = ⊿U p⊿V
それでは、「エンタルピー」とはいったい何か。エンタルピーとは「圧力一定の条件で系がもつエネルギーである」と考えることができる。
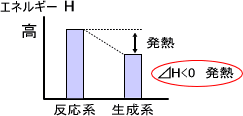
下の図では反応する前の系のエンタルピーよりも生成した系のエンタルピーの方が低い。つまり、エンタルピーが減った分だけエネルギーが減ったということである。圧力一定で系のエネルギーが減ったということは、減ったエネルギー分だけ熱量を放出したことになる。
⊿H = 「生成系のエンタルピー」 - 「反応系のエンタルピー」で、⊿H<0となる。
逆に⊿H>0ならば反応系から生成系に変化するときに、その分だけエネルギーを吸収することになる。つまり、吸熱反応である。
エンタルピー⊿Hがマイナス(⊿H<0)であるならその反応は発熱反応であり、⊿Hがプラス(⊿H>0)であるならその反応は吸熱反応である。
エントロピー
エントロピーSとは乱雑さの指標となる状態関数である。孤立系においての自然変化はエントロピーは増大する方向に働く。
熱力学第二法則とは「可逆反応ではエントロピーは一定であり、不可逆反応ではエントロピーは増大する」と表現されている。
熱い湯に冷たい物質を入れると温度が下がり、湯と物質の温度は同じになる。これは熱いものから冷たいものに熱が移動したためである。
物質がさらに冷たくなり湯が沸騰をはじめるという、冷たいものから熱いものへ熱が移動する反対の変化は起こらない。これは不可逆反応であり、エントロピーは増大する方向へ働く。エントロピーは次の式で求めることができる。
⊿S = q/T
物質のエントロピーの値を定めるには基準となる0の値を定める必要がある。熱力学第三法則は「すべての完全結晶のエントロピーは絶対零度で0である」としている。
・エントロピーの意味
ボルツマンはエントロピーを、統計力学の立場から
S = k・lnW
と定義した。kはボルツマン定数とよび、気体定数をR、アボガドロ数をNとすると次のように表せる。
k = R/N = 8.314(J/K・mol)/6.022×1023(mol-1) = 1.381×10-23(J/K)
いま、体積V1の容器と体積V2の容器があるとする。この二つの容器を体積vに分割して考える。すると、それぞれの容器でV1/V個、V2/V個の個室ができる。
ここに一個の気体分子があると考えると、体積V1の個室に1分子を振り分けるにはV1/V通りの方法があり、体積V2の個室に1分子を振り分けるにはV2/V通りの方法がある。
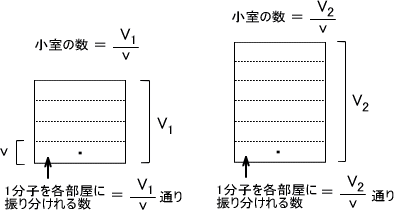
V1の容器にm個の分子があるとする。各個室に入る気体分子の数に制限がないとすると、m個全ての分子に対して各個室に振り分けるにはV1/V通り存在する。つまり、m個の分子を各個室に振り分けるには(V1/V)m通りがある。同様に V2の容器では(V2/V)m通りがある。
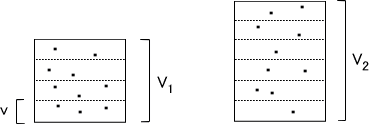
ボルツマンの式でWとは状態確率のことであり、ここではW1 = (V1/V)m、W2 = (V2/V)mと表すことができる。もし、体積がV1からV2に変化したとするとそのときのエントロピーの変化量は次の式で表すことができる。
⊿S = S2-S1 = k[ln(V2/V)m-(V1/V)m] = mk・ln(V2/V1) = nR・ln(V2/V1)
(m = nN、Nk = Rより)
ギブスの自由エネルギー
フラスコやビーカー内は孤立系ではない。そこで、一般的な反応の方向を知る必要がある。孤立系以外で反応が自然に起こるかどうかを知ることができる状態量としてギブスエネルギーG(自由エネルギー)が定義されている。ギブスエネルギーGは次のように表される。
⊿G = ⊿H - T⊿S
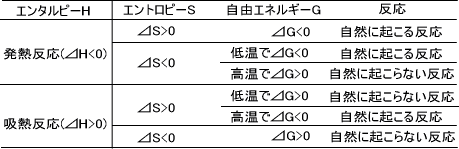
ギブスエネルギー変化⊿Gがマイナス(⊿G<0)であるならその反応は自然に進む反応であり、⊿Gがプラス(⊿G>0)であるならその反応は自然には進まない反応である。
発熱反応(⊿H<0)でエントロピーが正(⊿S>0)であるならギブスエネルギーは負(⊿G<0)となり、自然に起こる反応である。このとき、発熱反応(⊿H<0)でエントロピーが負(⊿S<0)であるなら低温ではギブスエネルギーは負(⊿G<0)となり自然に起こるが、高温ではギブスエネルギーは正(⊿G>0)となり自然に起こらない。
吸熱反応(⊿H>0)でエントロピーが正(⊿S>0)のとき、高温ではギブスエネルギーは負(⊿G<0)となり自然に起こるが、低温ではギブスエネルギーは正(⊿G>0)となり自然に起こらない。また、吸熱反応(⊿H>0)でエントロピーが負(⊿S<0)であるならギブスエネルギーは正(⊿G>0)となりいかなる温度でも自然には起こらない反応である。
・ギブスエネルギーと平衡定数
いま、次のような四つの気体の化学反応があるとする。
aA bB → cC dD
四つの気体の圧力がそれぞれPA、PB、PC、PDであるとすると、平衡定数Kは次のように表せる。
K = (PC)C(PD)D/(PA)A(PB)B
Kpは一定の温度で一定の値である。このときのギブスのエネルギーは次のように表せる。
⊿G = -RTlnK
この式と⊿G = ⊿H - T⊿S より、
⊿G = ⊿H - T⊿S = -RTlnK
lnK = -⊿H/RT + ⊿S/R
もし⊿Hと⊿Sが温度に無関係であれば、平衡定数の対数は「温度の逆数の一次関数」になる。
lnK = -⊿H/RT 定数 -①
縦軸をlnK、横軸を温度Tとしたときのグラフを下に示す。
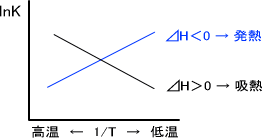
傾きが正なら①式より⊿H<0で発熱反応だと分かる。また、傾きが負なら⊿H>0で吸熱反応であると分かる。
スポンサードリンク
カテゴリー
スポンサードリンク
