モル伝導率・電気伝導率
モル伝導率と電気伝導率
電解質溶液における電気伝導率κ(カッパー)は電気の通しやすさを表す。電気伝導率κは下の式によって表わされる。
κ = 1/ρ = (1/R)(1/A)
ρは抵抗率と呼ばれており、この値が大きければ当然であるが電気抵抗が大きくなり電気が通りにくくなる。κはρの逆数なので、「電気の通しやすさを表す」ということが理解できる。
なお、1モルあたりの電気伝導率をモル伝導率Λ(ラムダ)と呼び、電気伝導率を濃度で割ることで導き出すことができる。
Λ = κ/c
ただし、濃度cの単位はmol/Lである場合、濃度cの単位を「mol/L → mol/m3」に直さないといけない。
上の式を見てわかるとおり、電解質溶液では濃度が低いほど電気を通しやすいということが理解できる。このとき、濃度cの平方根に対してモル伝導率をプロットすると下の図のようになる。
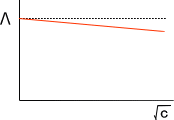
なぜ、濃度が高くなるとモル伝導率が減少するかであるが、濃度が高くなるとイオン同士が混み合うためである。つまり、イオン間の相互作用によって動きが妨げられる。
下に各電解質溶液のモル伝導率と濃度の関係を示す。
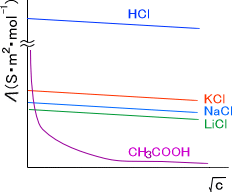
電解質には二種類の型がある。濃度が変化するにつれて直線的にモル伝導率が減少する電解質を強電解質といい、酢酸のように急激にモル伝導率が減少する電解質を弱電解質という。
原子の大きさはK>Na>Liの順なので、イオンの動きやすさはLi>Na>Kと考えるのが普通である。そのため、モル伝導率はLiCl>NaCl>KClと予想される。
しかし、現実では上の図を見てわかるとおり、モル伝導率はKCl>NaCl>LiClの順となっている。これには水和が関係している。
・モル伝導率がKCl>NaCl>LiClの順となる理由
イオンサイズが小さい場合と大きい場合を比較したとき、イオンサイズが小さい方が+の影響が大きいはずである。
そして、プラスの影響が大きい方がδ-に傾いている水と水和しやすい。なお、水和とは水とくっつくことである。
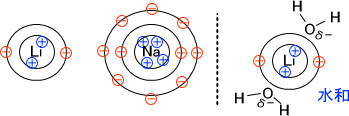
小さいイオンの方が水とくっつきやすいので、実際のイオンサイズが小さくても見かけ上大きいサイズのイオンとなってしまう。これが、モル伝導率がKCl>NaCl>LiClの順となる理由である。
また、H のモル伝導率が大きい理由であるが、これは水素結合を介してH+が移動するからである。
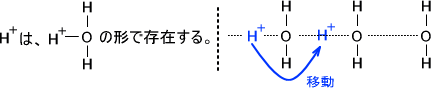
このように、自分(H )が動かなくても周りが動くことで移動できるのである。
コールラウシュのイオン独立移動の法則
濃度を限りなく薄めたとき、Λ=κ/cの濃度cには0が挿入される。このときのモル伝導率を極限モル伝導率Λ0という。(濃度を限りなく薄めた場合を無限希釈という)
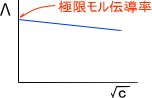
無限希釈の状態では、イオン間の相互作用を無視することができる。つまり、極限モル伝導率Λ0は存在するイオンの極限モル伝導率の和で求めることができる。
例えば、CH3COOHの極限モル伝導率を知りたい場合、H+とCH3COO-の極限モル伝導率の和を求めれば良いのである。
Λ0 = λ0(H ) + λ0(CH3COO-)
イオンの輸率
電解質溶液で電流が流れたとき、電流全体における正電荷と負電荷が寄与した割合を輸率という。正電荷と負電荷の輸率を足せば、必ず1になる。
スポンサードリンク
カテゴリー
スポンサードリンク
