界面張力、表面張力
界面張力
界面は気相と液相、液相と液相、液相と固相、固相と固相の二相間で形成される。この界面間で働く力が界面張力である。例えば、下の図のように平らな板に水滴を垂らしたとする。
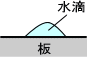
このとき、水滴は図のように半円状態となって留まる。これは、水滴内部の水分子はそれぞれファンデルワールス力を受けているからである。つまり、水滴はそれ自身の水分子によって内側に引っ張られているのである。この力は水滴が表面積を小さくするように働く。このような力を界面張力という。
特に、界面(表面積)を小さくするように働く力(界面張力)が液体に作用している場合は表面張力ともいう。
この界面張力の力はファンデルワールス力が強ければ強いほど大きい。つまり、物質の原子量や分子量が大きいほど界面張力の力は強くなる。
ここまで説明すれば、宇宙空間で「なぜ、水滴は球形をとるか?」を説明できるはずである。
水滴には表面張力が働いており、この水滴の表面積が一番小さくなるのは球形だからである。もちろん、水滴でなくて他の液体でも球形になる。
安定性
液体の界面には表面張力が働いている。この液体が曲面であるなら、液体内部の圧力は外の圧力よりも高く、過剰のエネルギーをもっている。これは、表面張力によって表面分子は常に内側に引っ張られているからである。
このときの外圧をPo、液体内部の圧力をPiとすると圧力差⊿Pは次の式で表すことができる。
⊿P = Pi - Po
また、楕円である液滴の半径(主曲率半径)をそれぞれr1とr2、界面張力をγとすると、ヤング・ラプラスの式から圧力差⊿Pは次のように表すことができる。
⊿P = γ(1/r1 + 1/r2)
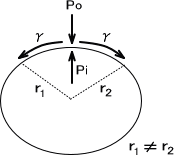
もし、液滴の曲面が球形なら半径r=r1=r2となる。
⊿P = 2γ/r
接触角
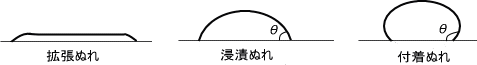
板に水滴を垂らしたとき、板の上を拡張してぬらす場合(拡張ぬれ)とレンズ状液滴を形成する場合の二種類が考えられる。
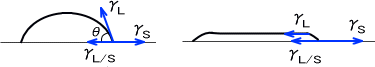
固体(板)の界面張力をγS、水の表面張力をγL、界面張力をγL/Sとすると、板の上を拡張してぬらす場合は次の式で表すことができる。
F = γS-(γL/S + γL)≧ 0
Fは拡張係数と呼ぶ。もし拡張係数FがF<0なら、水滴は拡張してぬれずにレンズ状となる。γL/SとγLの角度を接触角と呼び、このときの力の関係は次式(ヤングの式)で表される。
γS-γL/S = γLcosθ
また、接触角が0°<θ≦90°のときは浸漬ぬれ、90°<θのときは付着ぬれという。
界面への吸着
ある液体に溶質を溶かすとする。この溶質は界面か液体内部に分布することになるが、界面の溶質濃度が液体内部の溶質濃度よりも高くなる場合や低くなる場合がある。前者は界面に正に吸着するので正吸着と呼び、後者は負に吸着するので負吸着と呼ぶ。
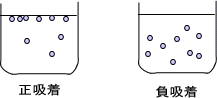
水にNaClやMgCl2などの無機塩を溶かすと液体内部に分布し、界面表面は真水に近くなる。これが負吸着である。
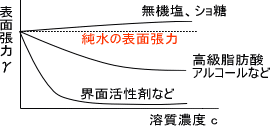
「なぜ、負吸着をするか」であるが、液体には表面張力が働いているためである。表面ではファンデルワールス力が液体内部からのみ働くため、溶質は液体内部に引っ張られることになる。
また、アルコールや高級脂肪酸、界面活性剤を溶かすと正吸着して表面張力を下げる。界面活性剤には界面張力の力を弱める働きがあり、水の中ではミセルを形成する。
界面活性剤には親水基と疎水基があり、疎水基は水になるべく触れないようにしようとする。そのため、界面活性剤を水に溶かすと疎水基を水からだそうとするため正吸着する。界面に正吸着すると、界面活性剤と水の相互作用は界面で起こるため表面張力は減少する。
溶液表面に対する溶質分子の吸着量を示すのにギブスの吸着等温式(Γ)がある。
Γ = 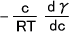
ラングミュアの吸着等温式
気体分子の固体表面への吸着を考えるとき、圧力をPで吸着した気体量Vと単分子層を形成するのに必要な気体量をVmax、aを定数とするとラングミュアの吸着等温式は次式で表される。
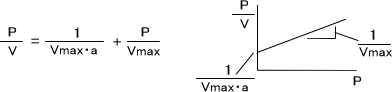
圧力によって吸着した気体の体積を実験で求めることができたなら、ラングミュアの吸着等温式から固体の表面積を求めることができる。
界面活性剤
界面活性剤は親水基と疎水基の両方が存在する両親媒性を示し、界面張力を弱める働きがある。また、両親媒性のためミセルを形成する。
界面活性剤は最初は界面に吸着するが、完全に界面に吸着してしまうとそれ以上吸着できない状態になるためミセルを形成し始める。この界面活性剤がミセルを形成し始める濃度を臨界ミセル濃度(cmc)という。
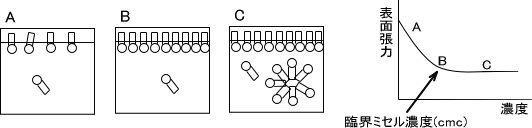
下の図に界面活性剤の濃度と物理化学的変化を示す。
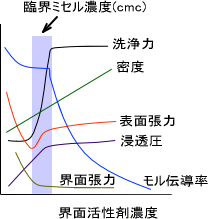
浸透圧は溶質の個数で決まる。cmcを越えるとモノマーではなくミセルを形成し、ミセル形成にはモノマーが50~100個必要なため浸透圧はゆるやかに上昇する。
モル伝導率とは1モルあたりの伝導率である。伝導度とは移動度のことで、小さいモノマーよりも大きいミセルの方が動きにくい。
クラフト点と曇点
・イオン性界面活性剤
イオン性界面活性剤の場合、溶解度は温度と共に上昇する。温度を高めていくとある温度で界面活性剤の溶解度が急激に上昇する温度があり、この温度をクラフト点という。
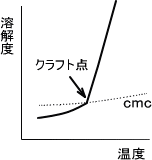
このクラフト点以上でミセルがよく形成されるため、可溶力や洗浄力はこの温度よりも高温で効果を発揮する。
・非イオン性界面活性剤
非イオン性界面活性剤の場合、温度を高めていくとある温度で水溶液が白濁する。この温度を曇点という。これは水との水素結合が切断され、水和度が減少するために起こる。
つまり、温度が高いと溶解度が減少して水に溶けにくくなる。この水に溶けなくなった分の非イオン性界面活性剤が白濁という状況を作り出すのである。
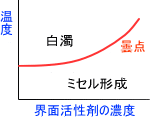
非イオン性界面活性剤は曇点以下の温度で効果を発揮する。
コロイド粒子
コロイド粒子の直径は10-6~10-9mであり、この粒子が安定して分散している溶液をコロイド溶液という。コロイドは親水コロイドと疎水コロイドに分けることができる。
親水コロイドにはタンパク質や水溶性高分子化合物などがあり、水中にコロイド粒子が溶解している。それに対し、疎水コロイドは金属、ステロイドホルモンなどの水に不溶性の物質であり、ただ単に水中で分散して存在しているだけである。
親水コロイドは溶媒化しているが、疎水コロイドは溶媒化しておらず親水コロイドと比べて不安定である。親水コロイドは多量の電解質で沈殿(塩析)するが、疎水コロイドは少量の電解質で沈殿(凝析)する。
コロイド粒子はろ紙を通過するが、セロハンや半透膜を通過することはできない。この性質を利用すれば、半透膜を使用することによって分子とコロイド粒子を分けることができる。また、コロイド粒子と分散媒(溶媒)との衝突によって起こるランダムの動きはブラウン運動という。
・疎水コロイドの安定性
疎水コロイドの安定性は次の二つによって決定する。
・ファンデルワールス力
・静電気的反発力
分子間に作用するファンデルワールス力は分子間距離の6乗に反比例したのに対し、コロイド粒子のファンデルワールス力はコロイド粒子間距離に1乗に反比例する。
・乳剤
溶液中に他の液体が分散して存在している場合を乳剤という。乳剤には水中に油が分散しているo/w型や油中に水が分散しているw/o型などがある。(oはoil、wはwaterのことである)
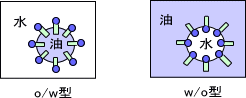
乳剤の種類は親水性と疎水性のバランスであるHLBによって決まる。HLBの値が大きければ親水性が高いことを意味しo/w型となる傾向がある。逆にHLB値が小さければ疎水性が高くw/o型となる傾向がある。
・コロイド粒子の散乱
コロイド粒子に強い光を当てると光の通路が輝く。この現象をチンダル現象と呼び、これは光がコロイド粒子に当たって散乱するために起こる。
散乱の度合いはコロイド粒子の半径の6乗に比例し、入射光の4乗に反比例する。つまり、強く散乱するには波長が短く、コロイド半径は大きい方が有利である。
スポンサードリンク
カテゴリー
スポンサードリンク
