抗体の構造・種類・特徴・働き
抗体の構造
血漿中に存在するタンパクの多くはアルブミンとグロブリンである。また、グロブリンは電気泳動による移動度によってα、β、γに分けられる。
1939年に「免疫反応前と免疫反応後の血漿タンパクの量を比べてみると、γグロブリンの量だけが増大していた」という報告があった。これによって、抗体はγグロブリンであるということが分かった。
抗体は長いポリペプチド鎖と短いポリペプチド鎖がそれぞれ二本ずつ、ジスルフィド結合(S-S結合)によって繋がっている構造を持つ。長いポリペプチド鎖をH鎖、短いポリペプチド鎖をL鎖という。
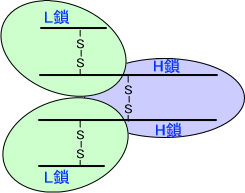
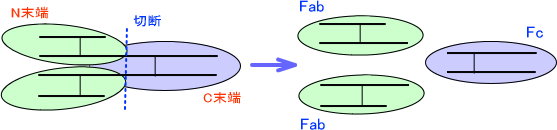
ここで、パパインという酵素を使って抗体を分解する。パパインはL鎖-H鎖を繋ぐジスルフィド結合とH鎖-H鎖を繋ぐジスルフィド結合の間を切断する。これによって、抗体は3つに分かれる。このときN末端側の産物をFab、C末端側の産物をFcという。(Fab×2 Fc)
またペプシンによって抗体を切断すると、H鎖-H鎖を繋ぐジスルフィド結合よりもC末端側を切るので、抗体は2つに分かれる。このときN末端側がF(ab´)といい、C末端側をFc´という。
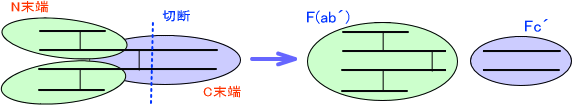
図を見れば分かる通りFabには1ヶ所、F(ab´)には2ヶ所の結合部位がある。これらは切断されて単独になっても抗原と結合することができる。
・可変部と定常部
Fabは抗原と結合する性質があり、N末端側から約半分(約110塩基)はアミノ酸配列が多様性に富んでいる。この領域を可変部という。また、可変部以外のFab領域とFc部のアミノ酸配列は一定である。この領域を定常部という。なお、Fcは補体の活性化など生物活性に必要である。
可変部の中でも、アミノ酸配列に特に多様性をもつ領域がある。この領域を超可変部(相補性決定領域)という。超可変部はH鎖、L鎖に3つずつ存在する。
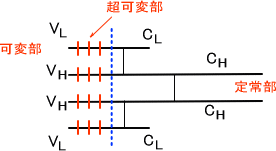
それぞれH鎖の可変部をVH、定常部をCH、L鎖の可変部をVL、定常部をCLという。
抗体の種類
抗体はμ,γ,δ,ε,αの5種類に分けられ、クラスまたはイソタイプとよばれている。また、抗体の種類とクラスはそれぞれ下のように対応する。
μ → IgM
γ → IgG
δ → IgD
ε → IgE
α → IgA
抗原と結合する超可変部の構造は抗体ごとに異なっている。このように、抗体はそれぞれ固有の抗原性を示す。これをイディオタイプという。
また、超可変部に対する抗体を抗イディオタイプ抗体という。抗イディオタイプ抗体が超可変部に結合していくと、今度は抗イディオタイプ抗体に対する抗体が結合していき、これが無限に続く。これが免疫ネットワークである。
抗体の特徴
抗体は5種類存在するが、それぞれ下のような性質を示す。
|
IgM |
IgG |
IgD |
IgE |
IgA |
分子量(万) |
100 |
16 |
18 |
20 |
16(分泌型39) |
|
補体活性 (古典経路) |
+++ |
++ |
- |
+ |
+ |
胎盤通過 |
× |
○ |
× |
× |
× |
形 |
五量体 |
分泌時は二量体 |
IgE、IgGはFc受容体を介して細胞に結合することができる。Fc受容体とはFc部と結合する受容体のことである。ただしIgEとIgGのFc受容体は異なるため、それぞれ異なる細胞に結合する。IgEは肥満細胞、好塩基球などに結合し、IgGは好中球、NK細胞などに結合する。
また、胎盤を通過できる抗体はIgGだけである。IgG抗体が胎盤細胞へ来ると、IgGはFc受容体に捕まえられて胎児側に送られる。そのため、生まれてくる胎児にはIgGの抗体が存在するが、それ以外の抗体は自分で作らないといけないので存在しない。
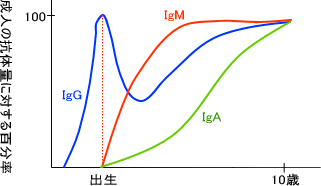
抗原に感染すると、抗原感染から日数が経つにつれて血液中の抗体量が変化する。例えばIgMとIgGを比べると、抗体感染の約一週間後にIgMの量が増えてそれから日数が経つとIgGの抗体量が増えだす。
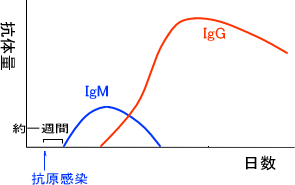
このようにIgMからIgGへ転換するときは遺伝子レベルで起こっている。抗体を産生する細胞は始め、必ずIgMを産生する。時間が経つと抗体産生細胞の遺伝子に変化が起こり、今度はIgGを産生するようになる。これをクラススイッチという。
また、粘膜上にはIgA抗体が存在しており、粘膜に存在するIgA抗体は外界からのバクテリアなどの病原菌の侵入を防ぐ役割をしている。
抗体の働き
抗体そのものが菌を殺すのではない。抗体が抗原に結合することで生体が様々な機能をもつである。抗体による効果には主に次の三つがある。
・中和
抗体が病原菌に結合すると、その病原菌がもつ毒性や増殖能力を抑制する。これを中和という。
・オプソニン化
抗体が病原菌に結合することによって、貪食細胞が抗原を認識して取り込むのを促進する。これがオプソニン化である。逆に、抗体が病原菌に結合しないと貪食細胞は食作用を示しにくい。
・補体系の活性化
抗体と病原菌との結合によって補体系が活性化する。補体が活性化するとオプソニン化が促進されたり、病原菌の細胞膜に穴を開けたりする。
抗体の多様性
抗体は1×108もの多様性を持つ。抗体産生細胞が抗体を産生するとき、遺伝子レベルで変化が起こっており、抗体が多様性をもつのはこのためである。
抗体産生細胞でH鎖をコードしている遺伝子にはV領域、D領域、J領域が存在し、その後にC領域が並んでいる。VDJ領域は抗体の可変部の機能を決定し、C領域は抗体のクラス(IgM、IgGなど)を決定する。
可変部の機能を選ぶとき、H鎖の可変部をコードする数あるVDJ領域から、それぞれ一つだけを選んで可変部を決定する。
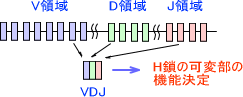
また、L鎖にはV領域とJ領域が存在し、H鎖のときと同じようにして可変部の機能を決定する。H鎖とL鎖の多様性を組み合わせると、3×106種類の抗体を産生することができることが分かる。
※H鎖・L鎖はそれぞれ3つ(VDJ)、2つ(VJ)の領域で決定する。
ただし、3×106では「抗体は1×108もの多様性を持つ」というのに矛盾してしまう。実は、抗体は前述以外の方法によっても多様性をもつようになる。抗体分子が多様性をもつようになるには、N領域の挿入なども関係している。
・N領域の挿入
N領域の挿入とは、抗体遺伝子にはない遺伝子が入ることである。これによって可変部の構造が変化する。また遺伝子の再編成時にずれが生じることがあり、これによっても多様性が生じる。
ヘプタマー・ノナマーの法則
VDJが選ばれるメカニズム(再編成)にはヘプタマー・ノナマーの法則が関係している。
V側に7塩基の決まった配列があり、この配列をヘプタマーという。ヘプタマーから23塩基後に、9塩基の決まった配列があり、この配列をノナマーという。ヘプタマー、ノナマーはそれぞれ水素結合し、ループする。ループすることによって遺伝子を再編成をする酵素が働きやすくなる。
遺伝子の組み換え(再編成)を行う酵素をリコンビナーゼといい、リコンビナーゼはRAG-1,RAG-2という遺伝子によってコードされている。
クラススイッチ
抗体のクラスはH鎖による。H鎖のVDJ領域の後にはC領域があり、C遺伝子によって抗体のクラスが決定される。

C領域の最初はμがコードされているので、最初に産生される抗体は必ずIgMである。それぞれのC遺伝子の前にはS領域(スイッチ領域)があり、このS領域同士が結合することによってループし、遺伝子の再編成が起こる。これによって、産生される抗体のクラスが変わる。これがクラススイッチである。
また、クラススイッチにはS領域が関与するもの以外に、RNA過程でのスプライシングによっても起こる。
T細胞受容体(TCR)
TCRにはαβ鎖からのものと、γδ鎖からのものがある。γδ鎖のTCRをもつT細胞は、特別なT細胞である。
TCRの多様性は抗体よりも多く、αβ鎖の場合は~1015、γδ鎖の場合は1018もの多様性をもつ。
スポンサードリンク
カテゴリー
スポンサードリンク
