速度反応論:酵素と基質、ミカエリス・メンテン式
恒常性を保つために、生体内の反応は適切な速度で進む。速度の影響因子には温度、pH、酵素、基質の濃度、阻害物質の存在がある。また、反応の進行には遷移状態を経由する。

平衡状態

酵素反応が平衡状態にあるというのは、正反応と逆反応の速度が同じということである。平衡とは動的平衡であり、反応が止まっているわけではなく A と B は絶えず AB に転換しており逆も起きている。
動的平衡のとき、
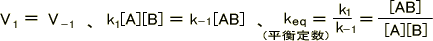 となる。
となる。
酵素反応はエネルギー障壁を下げるがkeqには影響しない。
反応例
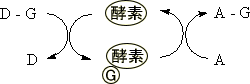
個々の反応では、基質と酵素の反応は1:1で反応する。
酵素はリサイクルされるため、全体では少量で足りる。
酵素の活性部位
活性部位=酵素の触媒部分
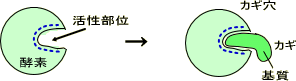
酵素には高い特異性、反応選択性があり、鍵と鍵穴の関係のように活性部位にぴったりとはまる物質のみ触媒する。
ミカエリス・メンテン式
ミカエリス・メンテン式は平衡状態が成立、定常状態のときに基質濃度が変化したときの酵素反応への影響を表す式である。
他の条件(酵素濃度など)が同じとき、それぞれ「初速度:V1」「最大速度:Vmax」「最大速度の1/2の速度を与える基質濃度:Km」とする。
ミカエリス・メンテン式は、
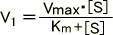 と表すことができる。この式を変形していくと次のようになる。
と表すことができる。この式を変形していくと次のようになる。
※[S]は基質濃度である。
逆数をとって、

ある酵素反応において、濃度における反応速度を求めてプロットする。その後、グラフの直線を延長しXとY切片を計算するとKm、Vmaxが分かる。
阻害
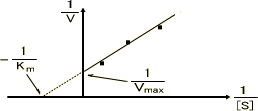
・競合阻害
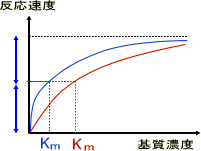
阻害物質は基質と類似の構造をもつことが多く、基質の結合部を取り合う。活性部位を取り合うことで反応を阻害するとき、Vmaxは変わらないがKmを上げる。反応速度を上げるためには、より多くの基質が必要である。
・非競合阻害
活性部位を奪い合わないが、別の部位に働いて酵素の働きを下げる。このときVmaxを下げるが、基質の結合自体は阻害しないためKmは変わらない。
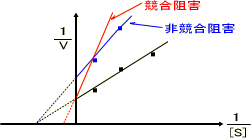
競合阻害や非競合阻害では、それぞれ左のグラフの
ように変化する。
酵素の活性の特徴
・高い基質特異性、高い触媒作用
・欠点として、タンパク質なので高温等では使えない
・酵素の作用機構が分かると、酵素をターゲットとした薬をデザインできる(酵素デザイン)
酵素の活性
例 キモトリプシン
p -ニトロフェノール酢酸をキモトリプシンにより加水分解させるとp -ニトロフェノールが生成する。p -ニトロフェノールは発色するので吸光度を測定すると生成量が分かる。
下の表はその時のp -ニトロフェノール酢酸とキモトリプシンを反応させた時の検出するp -ニトロフェノールの量と反応時間の表である。
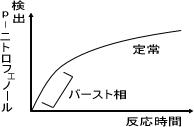
バースト相:キモトリプシン(CT)がCT-酢酸として飽和するまで。
定常状態:CT-酢酸から、CTの再生スピードが全体の速度を決定する。
p -ニトロフェノール酢酸とキモトリプシン(CT)が反応すると、p -ニトロフェノールとCT-酢酸を生成する。この場合、最初の方はキモトリプシンがどんどん反応していく。この部分がバースト相である。
しかし、キモトリプシンが全て反応して飽和状態になると、p -ニトロフェノールが生成するにはCT-酢酸からキモトリプシンへと再生されるまで待たないといけない。キモトリプシンが再生されると再びp
-ニトロフェノール酢酸と反応して、p -ニトロフェノールを生成する。
活性調節
酵素のKmは基質の細胞内濃度に近い - 受動調節
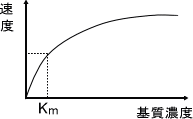
基質濃度上昇→酵素のスピード上昇
基質濃度下降→酵素の活性が下がる
基質の過不足が酵素活性を調節する。
アロステリック調節
酵素などに活性部位以外に物質が結合し、活性が強くなったり弱くなったりする。そのとき、酵素に結合し形を変える物質をアロステリックエフェクター(アロステリック酵素)という。これはフィードバック調節の機構の一つである。
フィードバック阻害とはある生合成経路の最終産物がその経路の特定の酵素活性を阻害する現象である。
例 酵素a、b、c、d によって触媒されるAからDまでの反応
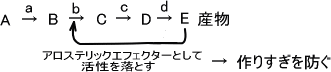
上の図では、高濃度のE がB からC への転換を阻害する。つまり、Eは特異的に酵素b と結合し阻害する能力をもっている。このように、産物Eは酵素b の負のアロステリックエフェクターまたはアロステリック阻害剤として働く。
その結果、酵素b のフィードバック阻害を介してE自身の生合成を調節する。
スポンサードリンク
カテゴリー
スポンサードリンク
