酵素反応
酵素とは生命の基盤をなす、動的過程を触媒する生体高分子である。
多くの酵素は補酵素を必要とする。補酵素は化学期の最終的な受容分子として、または反応の中間過程における担体として働く。
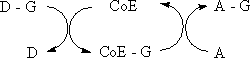 CoE:補酵素
CoE:補酵素
上の表示は、補酵素が官能基Gの中間的な担体として関与する反応である。
酵素の性質
酵素の性質としては次のようなものがある。
1. 酵素の触媒作用は立体特異性で、多くの基質は酵素と少なくとも3個の結合部を形成する三点結合である。
2. ある特定の反応だけを触媒し、原則としてほかの反応は触媒しない基質特異性という重要な性質をもつ。同じタイプの反応、限られた基質のみを触媒する。
3. 光学異性体を区別する光学特異性があり、ラセミ化しない(D体とL体を区別する)。
4. 微量すぎて物質として目に見えない量でも活性は検出できる。ある酵素が特異的に触媒する反応が起こるなら、その酵素が存在する可能性大である。
5. 酵素は細胞の特定の場所に存在する。
酵素の精製
酵素の性質を調べる際には共存物質の影響を除くため、純粋な酵素で調べる。
出発原料
1.自然界の生物試料から精製
2.その酵素の遺伝子は既知だが、酵素タンパクが未知のとき→組み換えDNA技術で大腸菌、酵母菌等に作らせる。
精製方法
1.沈殿法 2.ゲルろ過法 3.クロマトグラフィー 4.電気泳動 5.遠心分離法
精製手段としてクロマトグラフィーがよく用いられる
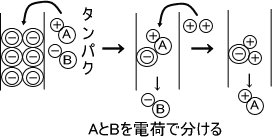
イオン交換クロマアトグラフィー |
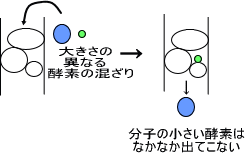
サイズ排除クロマトグラフィー |
|
|
|
イオン交換クロマトブラフィーは陽イオンと陰イオンが混ざっているときに、陽イオンのみまたは陰イオンのみを吸着させて生成する。 その後、吸着させたイオンと同じ荷電の物質により吸着したイオンを回収する。 |
サイズ排除クロマトグラフィーではサイズの異なる酵素を分ける。 |
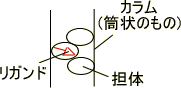
アフィニティークロマトグラフィー
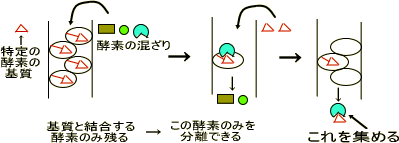
アフィニティークロマトグラフィーは酵素がいろいろと混ざっているときに、ある特定の酵素と特異的に親和力(結合力)をもつリガンドに酵素を吸着させて精製する。
この方法は精製効率がよく、特異性が高い。
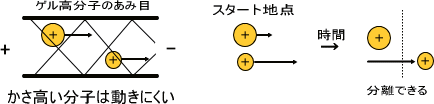
電気泳動
電荷と分子のかさ高さで分離する。
アイソザイム
同一固体中で化学的には異なるタンパク質が同一の酵素反応を触媒するとき、これらの酵素郡をアイソザイム(イソ酵素)という。同じ反応だが反応スピードが異なるためアイソザイムは種差、臓器差の原因のひとつとなる。アイソザイムは異なる遺伝子が支配している。
例、アルコールを摂取したきの悪酔いの原因を分解する酵素 (アセトアルデヒドデヒドロゲナーゼ)がある。これにはALDH1、ALDH2の2種類がある。日本人の生まれつき4割の人はALDH2がうまく働かない体質となっている。
その他
(1) 病気の診断に血しょう中の酵素量の定量がある。
正常な細胞の破壊に由来する酵素は常時少量存在する。
これが急激に増加すると細胞の大量破壊につながり病気となる。
(2) ある種のリボ核酸 (RNA)はタンパク質でないにもかかわらず、基質特異性の高い触媒活性を示す。このRNAをリボザイムという。
スポンサードリンク
カテゴリー
スポンサードリンク