電子軌道
イオン
陽イオンをカチオン、陰イオンをアニオン、H をプロトンという。
存在確率
電子軌道を説明するには高校の時の概念を捨てないといけない。高校の時にはほとんどの人が下の図のように電子は核の周りをぐるぐると回っていると思っていたはずである。
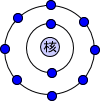
しかし実際は違う。電子軌道とは「電子の存在しうる空間」である。ここでの空間とは電子の存在確率である。
つまり、そこに電子が存在する確率が高いということである。例えば、水素の電子はK殻に存在する確率が高いということになる。炭素の電子はK殻とL殻に収まっている確率が高い。
sp軌道
L殻の電子の軌道は二つに分けることができ、それぞれs軌道とp軌道という。s軌道には電子が2個、p軌道には電子が6個入ることができる。また、K殻はs軌道だけである。
M殻になればs軌道とp軌道のほかにd軌道が加わる。M殻には1個の3s軌道、3個の3p軌道、5個の3d軌道をもつ。つまりd軌道には電子が10個入ることができ、M殻には電子が18個入れることができる。
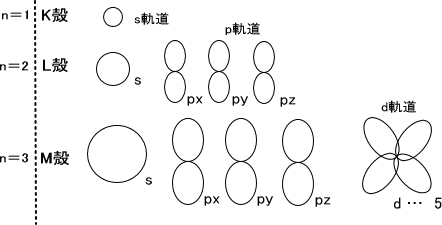
K殻からM殻になるにつれて軌道を大きく描いたのは、それにつれて電子が存在する確率の部分が広がってくるからである。
軌道の方向
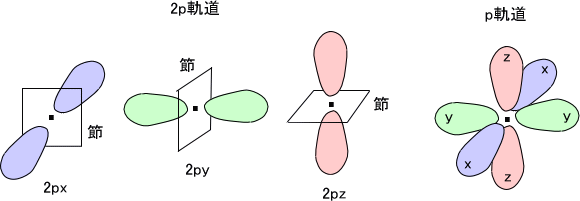
2p軌道は3つあり、三次元空間の3方向に2px、2py、2pzとx、y、z軸方向に対応づけられている。
基底状態
電子はエネルギーの低い軌道から順に収容される。
1s → 2s → 2p → 3s → 3p → 4s → 3d → …
例 Si(14)の基底状態の電子配置
(1s)2(2s)2(2p)6(3s)2(3p)2 価電子は4個
Zn(30)の基底状態の電子配置
(1s)2(2s)2(2p)6(3s)2(3p)6(4s)2(3d)10 価電子は2個
パウリの排他原理
一つの原子軌道には電子は2個しか入ることができない。しかも、その電子はお互いに逆向きのスピンをしている。これをパウリの排他原理という。
電子はスピンしながら自転している。電荷をもった物質が回転すると磁力が発生する。その磁力を打ち消すには、反対向きに電子が入ればよい。
もし電子が原子核から遠くなれば、それだけ電子が核に引き付けられる力が弱くなる。つまり、不安定になる。

フントの法則
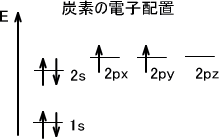
s軌道以外の軌道、つまりp軌道やd軌道などの同じエネルギーをもつ軌道に電子が入るとする(例えばp軌道は三つのエネルギーが等しい軌道がある)。電子が収容されるときは最初は一つの軌道に1個ずつ電子が収容される。また、これらの電子はすべて同じ向きに回転している。
下に炭素の電子配置を示す。
主量子数、方位量子数、磁気量子数
K殻、L殻、M殻…に対応してK殻をn=1、L殻をn=2…とする。nは主量子数であり、n=(1、2、3…)となる。つまり、主量子数は電子が存在する電子殻を区別する。
方位量子数はlで表され「n-1」で求める。これは軌道の形を決めるものである。
磁気量子数はmで表され「-l、-(l-1) … -1、0、1 … 1-l、 l 」で求める。これは軌道の方向を決める。
例
n=1のとき l=0(s軌道) m=0
K殻のときn=1である。軌道はs軌道だけなのでl=0である。s軌道は一種類だけで方向がないのでm=0となる。
n=2のとき l=0(s軌道) m=0
l=1(p軌道) m=-1、0、1 (px、py、pz)
L殻のとき軌道はs軌道とp軌道があるため、方位量子数はl=0、1である。l=1のときはpx、py、pzの3方向があり、磁気量子数は-1、0、1となる。
n=3のとき l=0(s軌道) m=0
l=1(p軌道) m=-1、0、1 (3方向)
l=2(d軌道) m=-2、-1、0、1、2 (5方向)
波動関数
電子の存在確率を表すには波動関数で計算できる。
「波動」とは性質のことである。性質であるため、動きでない。ただしこの性質は一つでは表れない性質であり、二つ以上が必要である。
例えば同じ波が合わされば増強するし、反対の波が合わされば打ち消し合う。
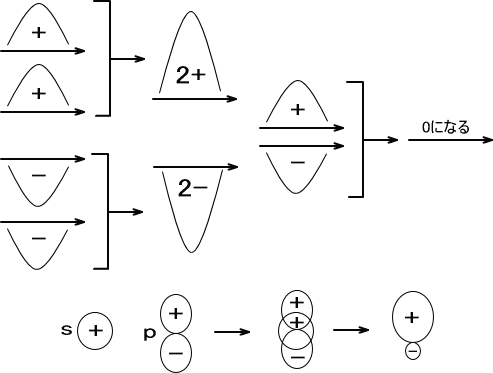
増強したり打ち消しあったりできる性質を波動という。y=ax (a>0)の関数ではxに代入する数値を大きくしていくと、答えの値は大きくなるだけであるが、波動関数ではこのような増強や打ち消しを表現できる。
混成軌道
混成軌道とは実在しないが人間が理解するのに都合の良いツールである。ここでは、炭素を例として説明する。
・sp3混成
実際にはs軌道とp軌道とではエネルギーが違うが、ここではs軌道とp軌道のエネルギーが同じだと考える。すると、一つのs軌道と三つのp軌道が交じり合うsp3混成軌道を形成する。
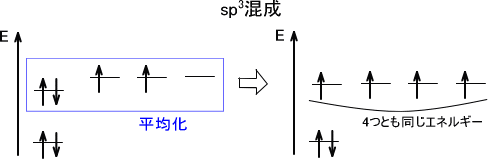
このとき、「四つの軌道を組み合わせる」とする。四つの軌道はそれぞれ最も安定な形をとろうとするため、互いの軌道が最も離れた配置となる。四つの軌道が最も離れた形をとるのは正四面体形である。このとき、互いの角度は109.5°となっている。
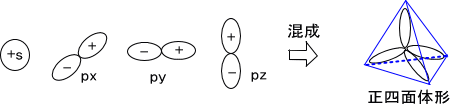
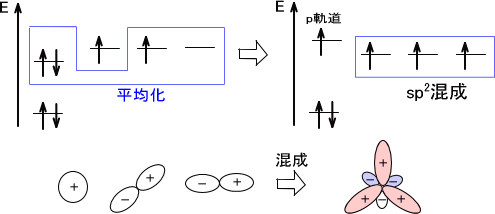
・sp2混成
今度は一つのs軌道と二つのp軌道が交じり合うとsp2混成軌道を形成する。このとき三つの軌道を組み合わせて、それぞれの軌道が最も離れた配置(最も安定な配置)をするには120°の角を形成すればよい。
このとき sp2混成軌道に関与していないp軌道の電子が一つある。
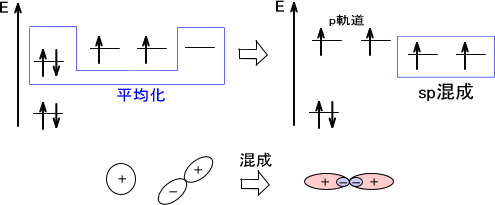
・sp混成
ここでは、一つのs軌道と一つのp軌道が交じり合うとsp混成軌道を形成する。このとき二つの軌道を組み合わせて、最も離れた配置をするには180°の角を形成すればよい。
スポンサードリンク
カテゴリー
スポンサードリンク
