結合と共鳴
σ結合、π結合
sp2混成軌道の例としてエチレンがある。この混成を利用した結合がσ(シグマ)結合である。また、混成に関与していないp軌道に不対電子が存在すると互いに結合を形成する。これがπ(パイ)結合である。
下に、エチレンとアセチレンの結合の様子を示す。
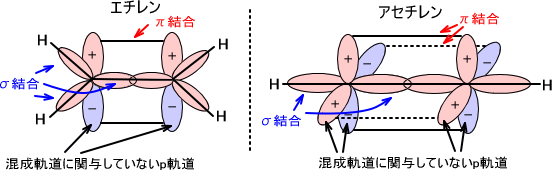
混成軌道に関与していないp軌道はπ結合を形成し、p軌道は必ずσ結合を形成している軌道に垂直になる。
例としてsp2混成軌道を考える。sp2混成軌道でpx軌道とpy軌道がσ結合に関与しているとする。すると、pz軌道がπ結合に関与することになる。
pz軌道はpx軌道とpy軌道に垂直となるので上のようなことが言える。sp混成軌道でもpx軌道がσ結合に関与しているとすると、py軌道とpz軌道がπ結合を形成する。py軌道とpz軌道はpx軌道に垂直である。
またσ結合とπ結合の強さは違う。σ結合の方がπ結合よりも結合は強い。これはσ結合は重なり合って結合を形成し、π結合はp軌道によって結合を形成するためである。
例えばあなたが他人と握手をするとき右手と右手をお互いに差し出すとする。すると、しっかりと握手ができるはずである。この状態が重なりによって結合を形成するσ結合の状態である。
今度は手を真上に上げて握手をしようとする。これはかなり困難である。これがσ結合に対して垂直となるp軌道どうしの結合、つまりπ結合である。こう考えると、どうしてπ結合よりσ結合の方が結合が強いかを容易に理解できるはずである。
結合性軌道と反結合性軌道
二つの水素原子が近づいていくと1s軌道が重なり合って結合が形成される。これが分子軌道である。
軌道同士が重なり合うことで形成される分子軌道であるが、軌道が重なり合うと必ず二つの軌道が形成される。一つは1s軌道よりもエネルギーが低く安定である結合性軌道である。もう一つは、1s軌道よりもエネルギーが高く不安定である反結合性軌道である。
反結合性軌道はその名の通り、結合に反する軌道である。しかし良く考えれば、エネルギーが高くなるので結合に反するのは当たり前である。多くの場合、物質はエネルギーの低い方向に進みたがるのである。
一つの軌道に入ることのできる電子は2個である。水素分子の二つの電子は結合性軌道に入るので、水素原子の状態よりも安定となる。しかし、ヘリウムを考えるとHe2 では電子の合計は4個となる。この状態では4個の電子のうち、2個は結合性軌道に入るがほかの2個は反結合性軌道に入る。結合性軌道による安定化よりも反結合性による不安定化の方が大きいため、ヘリウムは分子を形成しない。
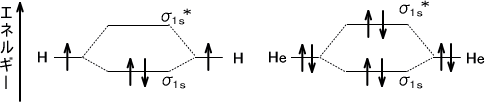
反結合性の軌道にはσやπに*(スター)をつける。二つの原子の2s軌道では、結合性軌道であるσ2sと反結合性軌道であるσ2s*ができる。
次に2p軌道を考える。二つの原子の結合軸をx軸とする。すると、2pxではσ2px軌道とσ2px*軌道ができる。また、2pyと2pzの軌道は2pxに垂直である。そのため垂直方向での結合性と反結合性の分子軌道ができる。それぞれ結合性の軌道をπ軌道、反結合性の軌道をπ*軌道という。
化学結合
多くの典型元素の原子は最外殻、8個の電子をもつと最も安定化する。これを、オクテット則という。ルイス構造(点電子構造)で書くとオクテット則をみたしているかすぐに分かる。
また、結合の様子を書くにはルイス構造のほかにケクレ構造がある。

共鳴構造
炭酸を考えると全ての原子がオクテット則も満たす構造を書ける。しかし、このとき三つの構造を書くことができる。
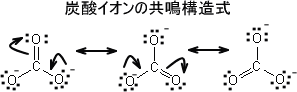
これらの構造式は核の位置は変えずに電子対だけを動かすことにより書くことができ、これらを共鳴構造という。炭酸イオンは上の三つの構造間で素早く変換しているという意味ではない。
このように電子が分子内の複数の原子にまたがっており、電子が分散して存在していることを非局在という。この非局在化は安定化につながる。つまり、共鳴式を多く書けるとそれだけ安定化につながる。
非局在化エネルギー
非局在化により安定化するとケクレ構造によって予想されるエンタルピーよりも、実測値のエンタルピーは小さい値を示す。このケクレ構造より予想されるエンタルピーと実測値によるエンタルピーの差を非局在化エネルギーまたは共鳴エネルギーと呼ばれる。
例えばベンゼンを考える。シクロヘキセンの水素化エンタルピーは⊿H=-120kJ/molであり、シクロヘキサン-1,3-ジエンの水素化エンタルピーは⊿H=-232kJ/molである。つまり、二重結合が一つ増えるとエンタルピーの値が112kJ/mol大きくなるとケクレ構造から予想できる。
しかし、ベンゼンの水素化エンタルピーの実測値は⊿H=-206kJ/molである。
スポンサードリンク
カテゴリー
スポンサードリンク
