ヘテロ環化合物の性質と配向性
水溶性の減少
π欠如系のヘテロ環化合物は水に溶けることができる。しかし、その構造によっては水溶性が減少することがある。
水溶性が減少する構造は、例えば下のようにピリジンのオルト位に-OHや-NH2が存在する場合に起こる。この状態では水分子だけでなく、環に結合しているHとも水素結合してしまう。そのため、水和性が減少するのである。
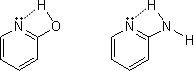
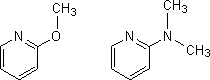
もしこれらの化合物の水溶性を増大させたいなら、下のようにNやOに結合している水素をCH3に置換してやればよい。こうすることで環内での水素結合がなくなり、水分子だけと水素結合するようになる。
ラクタム-ラクチム互変異性
環内にアミド(-CONH-)をもつ場合、それぞれ二種類の構造を描くことができる。-CONH-がラクタムであり、この互変異性がラクチムで-C(OH)=N-である。
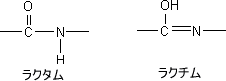
ピリジンやピリミジンの2位または4位に-OHがある場合、このような互変異性が存在する。
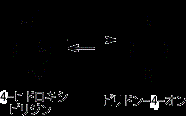
上図のように、4-ヒドロキシピリジンとピリドン-4-オンがあるとき、ピリドン-4-オンでは下のように双性イオン系共鳴構造式を描くことができるので、ピリドン-4-オンの方が安定となっている。
求電子置換反応
・ヘテロ五員環化合物
ヘテロ五員環化防物(π過剰系)に求電子試薬が反応する場合、2位または3位に求電子試薬が結合することになる。このとき、どちらが主生成物かを考えようと思う。それぞれ2位と3位に結合した場合の共鳴構造式は下のようになる。
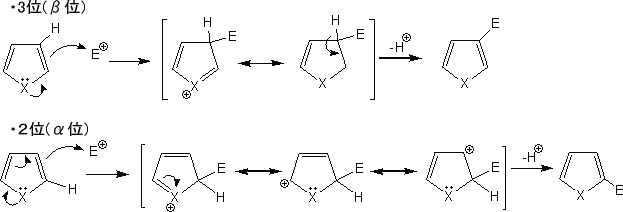
このように2位に求電子試薬が結合した方が、結合したときの共鳴構造式を多く描くことができる。よって2位に置換反応がより進むため、α位(2位)に置換する化合物の方が主生成物である。
・ヘテロ六員環化合物
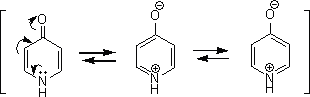
ヘテロ六員環化合物には求電子置換反応が起こりにくい。これはヘテロ六員環化合物がπ欠如系であり、炭素の方に電子が少ないためである。
そのため、ピリジンなどに求電子置換反応を起こそうとすると過酷な条件下で行わないといけない。なお、ピリジンに求電子試薬(カチオン)を置換させる場合、必ず3位で起こる。
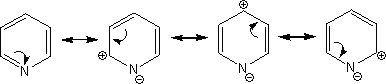
上にピリジンの共鳴構造式を示したが、3位にのみδ+性を帯びていない。これが3位にのみ置換反応が起こる理由である。
求核付加反応
π欠如系芳香族複素環の2位へアミノ基を導入する方法として、チチバビン反応がある。ピリジンをN,N-ジメチルアニリン中でナトリウムアミドと加熱することで、2-アミノピリジンを得ることができる。
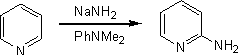
他の有機金属化合物でもπ欠如系芳香族複素環の2位に付加する。
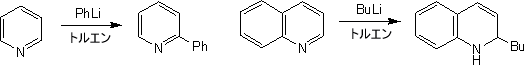
2位だけでなく4位に付加することも考えられるが、一般的に有機金属化合物の付加反応は2位に起こる。これは、有機金属が窒素原子に引き付けられるためである。
求核置換反応
2-ハロピリジンまたは4-ハロピリジンは容易に求核試薬と置換反応を起こす。しかし、3-ハロピリジンは求核置換反応が起こらない。これは、3位の反応中間体ではNに![]() が来る共鳴構造式を書くことができないため、不安定となるからである。
が来る共鳴構造式を書くことができないため、不安定となるからである。
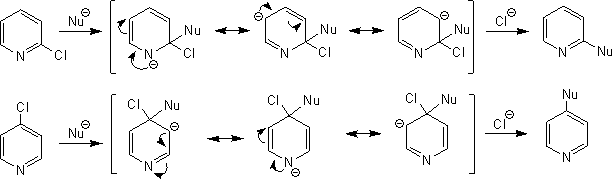
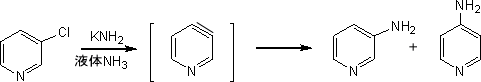
3-ハロピリジンは求核置換に対して不活性であるが、これを強塩基で処理すると異なる機構で置換反応が起こる。
例えば、液体アンモニア中でカリウムアミドと3-クロロピリジンを反応させると、中間体としてピリダインを経し、3-アミノピリジンと4-アミノピリジンが生成する。
スポンサードリンク
カテゴリー
スポンサードリンク
