ヘテロ環化合物
ヘテロ環化合物とは
窒素や酸素、硫黄原子など含んでいる化合物をヘテロ環化合物という。医薬品の中にはヘテロ環化合物がとても多く、ヘテロ環について学ぶことはとても重要である。なお、ヘテロ環は別名「複素環」とも呼ばれている。
ヘテロ環化合物には脂肪族化合物と芳香族化合物の二つがある。芳香族化合物の中で、さらにπ過剰系ヘテロ環化合物とπ欠如系ヘテロ環化合物に分けることができる。
π過剰系ヘテロ環化合物
π過剰系を考えるには、五員環の化合物を考えたら分かりやすい。
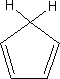
いま、上のような五員環の化合物があるとする。この化合物に塩基が作用してプロトンを引き抜くとすると、ベンゼン環のように環全体に6個の電子が散らばるようになる。
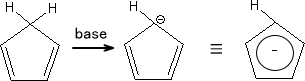
6個のπ電子は5個の炭素上に分散して存在していることになる。このとき、「6/5=1.2」で一つの炭素原子はそれぞれ1.2個分の電子をもつことになる。つまり、ベンゼン環よりも電子密度が高いのである。これがπ過剰系である。
π過剰系のヘテロ化合物は環全体に電子が分散している。
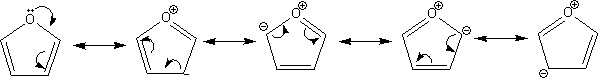
π欠如系ヘテロ環化合物
π過剰系のπ電子密度が1.00~1.20なのに対し、π欠如系のπ電子密度は1.00以下である。
π欠如系の芳香環では電子を環に押し出すよりもむしろ引きつける。これによって、電子が窒素原子などに集まり、環全体が+を帯びることになる。
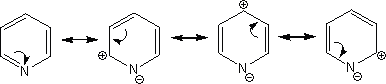
ピリジンとピロールの性質の違い
ピリジンとピロールの性質の違いとして大きなものに次の二つがある。なお、ピロールはπ過剰系でピリジンはπ欠如系である。
・ピロールは難溶性であるが、ピリジンは水溶性である。
・ピロールは酸性、ピリジンは塩基性物質である。
・なぜピリジンが水に溶けるのか
ピリジンはπ欠如系であるため、窒素原子は-の電荷を帯びている。このとき、水の水素原子はδ+の電荷を帯びており、ピリジンの窒素原子に引き寄せられる。
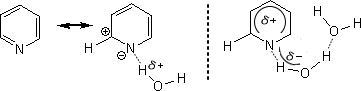
このように水分子はピリジンに引き寄せられる。そして、水分子同士で水素結合をどんどん広げていくのでピリジンが水に溶けるのである。
・なぜピロールが酸性を示すのか
アミンなどの感覚から一見ピロールは塩基性だと思われるかもしれない。しかし、実際には弱い酸性を示す。
塩化水素(HCl)を考えたとき、Clの方が電気陰性度が大きいので電子はClの方に強く引き寄せられる。そして、塩化水素が電離したとき最終的にH とCl-に分かれてしまう。これと同じようなことがピロールにも起こっているのである。
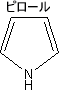
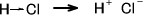
ピロールの窒素原子は電子を環に押し出す。そのため環全体は-の電荷を帯びているが、窒素原子は+の電荷を帯びている。
ピロールの場合窒素原子に水素原子が結合しており、窒素と水素を比べると当然窒素の方が電気陰性度が強い。そのため、水素の電子は窒素の方に引き付けられるのである。
なお、このとき窒素原子は+の電荷を帯びているためさらに強く水素原子の電子を引き寄せることになる。これによって水素がH として遊離し、ピロールが酸性を示すようになるのである。
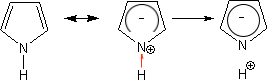
このように、ピロールの窒素原子に結合している水素原子は酸性の水素なのである。
スポンサードリンク
カテゴリー
スポンサードリンク
