オクテット則と電子の流れ
オクテット則
電子の動きを理解するためには、まず最初にオクテット則を理解しないといけない。
ただし、オクテット則は全く難しくない。「第二周期の原子が安定な分子やイオンを形成するとき、最外殻の電子は8個である」というだけである。最外殻に電子が8個ある状態は希ガスと同じ電子配置であり、安定であるということは既に知っていると思う。
それでは次の問題を考えてみてほしい。
問 BH4、CH4、NH4のルイス式を形式電荷を含めて書け。
※ルイス式は電子式で、形式電荷は-,+の電荷のことである。
多くの人はCH4、NH4は簡単に答えることができるのではないだろうか。しかし、BH4は少し戸惑ってしまうのではないだろうか。
この問題を考えるときはオクテット則がとても重要になってくる。逆に言えば、オクテット則さえ理解していれば簡単に解くことのできる問題である。それでは問題を考察していきたいと思う。
まず、それぞれの原子(B,C,N)がもつ電子について考えてみる。原子番号はそれぞれB=5,C=6,N=7なので、最外殻に存在する電子は次のようになる。
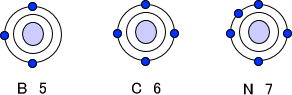
まずCH4を考えてみる。Cの最外殻には電子が4つ存在するので、オクテット則を満たすには電子が4つ必要である。Hがもつ電子の数は1つなので、Hが4つ付けばオクテット則を満たす。。
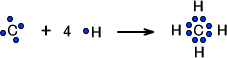
次にNH4を考えてみる。Nの最外殻には電子が5つ存在する。オクテット則を満たすには電子は3つしか入ることができない。しかし、Nには水素原子が4つくっついている。
これを可能にするためには、1つのHから電子を1つ取り去ればいいのである。+の電荷を帯びたH+が結合することになるのでNH4は+の電荷を帯びることになる。
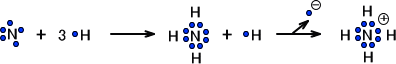
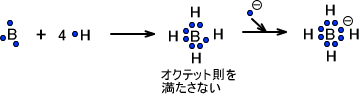
最後にBH4を考えてみる。Bの最外殻には電子が3つ存在する。つまり、BにHが4つ結合してもオクテット則を満たすことはできない。オクテット則を満たすためには電子が1つ足りないのである。
そのため、BH4になるために電子を1つとってくる必要がある。電子が1つ分だけ余分にあるのでBH4は-の電荷を帯びているのである。
これで、ここの問いを完璧に理解できたはずである。また、それぞれC,N,Oについて形式電荷を考えてみると次のようになる。
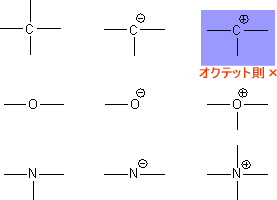
この形式電荷の図を見てみると、カルボカチオンだけがオクテット則を満たしていないことが分かる。つまり、カルボカチオンはオクテット側を満たしていないために不安定なのである。
電子の流れ
電子の流れを表すには曲がった矢印を使う。

この矢印には決まりがあり「電子過剰のものから電子不足のものに描く」というものである。また、この矢印を描くときには原子の性質を正確に表さないといけない。
例えば、H2OがOHとHに分かれるときの電子の動きを書くと下のようになる。
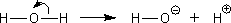
しかし、次のような電子の動きは考えられないだろうか。
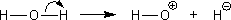
結論から先に述べると、このような反応は起こらない。なぜなら共有電子は電気陰性度の大きい原子に移動するという性質があるからである。電気陰性度が大きいほうが電子を強く引き付けるので当然といえば当然である。
反応を考える時にはいくつかのポイントがある。
・反応途中でヒドリド(H-)を出してはいけない。
・C-C結合をむやみに切ってはいけない。
・オクテット側に注意する。
ただし、例外として反応途中でC-C結合が切れる反応もある。
反応の種類
有機反応を考えるとき、大きく2種類の反応がある。
・求核的反応
・求電子的反応
・その他
主に求核的反応は「マイナスから始まる反応である」と考えておけばよい。つまり、塩基性の試薬によって反応が始まる。
それに対し、求電子的反応は「プラスから始まる反応である」と考えればよい。求電子的反応の逆で酸性の試薬から反応が始まる。
それでは実際に電子の流れを示してみようと思う。求核的反応の場合は次のような電子の流れしかない。
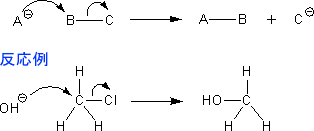
また、求電子的反応も次の2種類しかない。
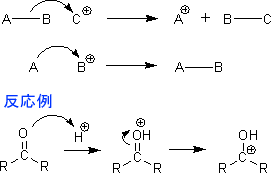
有機化学は暗記の科目ではない。このような反応機構を一つずつきちんと理解していけば、暗記しなくても問題を解くことができるはずである。
なお、塩基性と求核性にはある程度の相関がある。求核性の一部として塩基性があると考えればよい。

脱プロトン化
ヒドロキシル基の酸素原子が他の原子を攻撃して結合をつくるとき、酸素原子に結合していたプロトンはすみやかに離れる。これが脱プロトン化である。
この反応の例を下に示す。
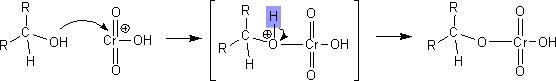
多くの教科書ではこの脱プロトン化の反応が省略されている場合が多い。そのため、このサイトでも脱プロトン化を省く場合があるのでご了承していただきたい。
なお、脱プロトン化は酸素原子だけでなく窒素原子でも起こる。
共鳴
電子式を描くにしても、同じ分子で複数の電子式を描くことができる場合がある。このとき、原子の位置は全く同じだが電子の位置だけが異なっているのである。共鳴式はオクテット則に従う。
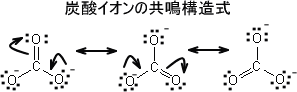
共鳴式を多く描くことができれば、それだけ電子が分子全体に分散しているということができる。このように全体に分散していることを非局在化という。電子が非局在化していると、その分子は安定になる。つまり、共鳴式を描ければ描くほど安定なのである。
スポンサードリンク
カテゴリー
スポンサードリンク
