紫外可視吸収スペクトル
光の基礎知識
物質に色があるのは光が当たるからである。光が吸収されることによって物質に色があるように見えるのである。
分子は安定な状態(基底状態)を保とうとする。しかし、光が当たると分子は光のもつエネルギーを吸収してエネルギーの高い状態(励起状態)に変化してしまう。
分子の安定な状態が基底状態であり、光エネルギーを吸収した後のエネルギーの高い状態が励起状態である。励起状態になった分子は、すぐに安定な基底状態に戻ってしまう。
可視光の光の波長はλ(nm)で表し、1nm=10-9mである。
光の振動数をν(Hz(ヘルツ))、光のエネルギーをE、プランク定数をh、光の速度をcとすると光エネルギーEと振動数νは次の式で表すことができる。
E = h×ν -①
ν = c/λ -②
①式と②式を組み合わせると、次式のようになる。
E = h×c/λ -③
hは定数、cも光の速度で定数なので光のエネルギーは波長によって決定される。
③式を見て分かるとおり、波長が短いとエネルギーが大きくなる。つまり、可視光よりも紫外線の方が波長が短いのでエネルギーが強い。
全ての光学分析には電磁波が関わっている。電磁波は波長の長さによってγ線、X線、紫外線、可視光、赤外線、マイクロ波、ラジオ波という具合に区別される。
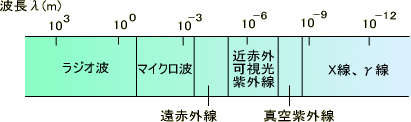
電磁波は体に悪いのかという問いであるが、「電磁波が体に害であるとは限らない」というのが正解である。γ線やX線はもちろん体に害であるが、赤外線やマイクロ波になってくるとエネルギーはかなり低くなる。
「えっ、それでは電子レンジはどうなのですか。体に害なのではないですか。携帯電話の電磁波の害は…。」
電子レンジや携帯電話はマイクロ波を使っている。つまり、可視光と比べても103くらいエネルギーが小さいのである。電子レンジや携帯電話の電磁波の心配をするくらいなら、太陽光線からの紫外線や健康診断でのX線の影響を心配した方がいいと思うが…。
余談ではあるが、UVカットの商品は紫外線を吸収する物質を含んでいるということである。紫外線を吸収することで紫外線が皮膚まで影響を与えるのを防ぐのである。
吸光光度
吸光光度法は「光が物質を透過する時、物質がどれくらい光を吸収したか」を調べる方法である。
いま、単色光がI0の強度で溶液を透過したとする。透過した後の単色光の強度をIとすると、透過度tと透過度tの百分率である透過率Tは次のように表す。
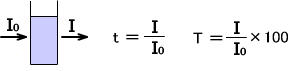
吸光度Aは透過度tの常用対数をとり、正にするためにマイナスをつけたものである。
A = -log(I/I0) = -log t
吸光度Aは濃度一定では光が透過するセルの長さlに比例する。これをランベルトの法則という。また、吸光度Aは濃度cに比例する。これをベールの法則という。この二つの法則を組み合わせると、吸光度Aを次のように表すことができる。
A = εcl
この関係をランベルト・ベールの法則という。このとき、cを1mol/Lの溶液、lを1cmにしたときの吸光度をモル吸光係数εという。
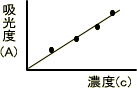
透過率Tに対して、その対数である吸光度Aは直線的に変化する。そのため、濃度と吸光度の関係をプロットしていけば検量線を作成でき、この検量線から物質を定量できる。
紫外可視吸収スペクトルの原理
紫外可視吸収スペクトルは紫外部および可視部の光を吸収することで得られるスペクトルである。可視部の波長は約360~780nmである。それに対し、紫外部は可視部よりも低波長側の約200~360nmである。
当たり前であるが、光が当たるとヒトは物質固有の色を見ることができる。これは物質が吸収した波長の光以外の光をヒトの目が認識するからである。
例えば、青色の物質があるとしたらその物質は青色以外の光を吸収しているということである。青色を吸収しないので、青色の光だけが反射して目に入ってくる。これが青色の物質が青色に見える理由である。
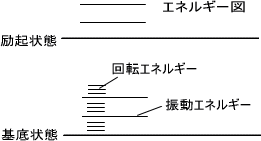
分子のもつエネルギーは電子エネルギー、振動エネルギー、回転エネルギーの三つがあり、どのエネルギーにも基底状態と励起状態が存在する。
エネルギー図としては電子エネルギーの中に振動エネルギーがあり、振動エネルギーの中に回転エネルギーがあるようになっている。つまり、基底状態と励起状態のエネルギー遷移の差は電子エネルギー>振動エネルギー>回転エネルギーの順となる。
電子が励起するということは安定な状態(基底状態)からエネルギーが高い状態(励起状態)に移行するということである。このとき、単結合に関係するものにσ→σ*遷移がある。この遷移はエネルギーが大きく遠紫外領域に見られる。
二重結合、三重結合に関係するものにπ→π*遷移があり、この遷移は紫外部から可視部まで現れる。
また非共有電子対が入る軌道としてn軌道がある。n軌道からの励起は非結合性軌道から反結合性軌道への励起であり、n→σ*とn→π*の遷移がある。n→σ*遷移は紫外部に現れ、n→π*遷移は紫外部から可視部に現れる。
可視領域に吸収帯をもつということはπ電子かn電子をもっている可能性があるということである。なお、これら電子のエネルギー順位はσ<π<n<π*<σ*という順になる。
紫外吸収スペクトル
紫外吸収スペクトルは共役系構造の有無が分かる。簡単に言えば共鳴式を書けるかどうかである。当然、構造式にベンゼン環があれば紫外吸収スペクトルがある。
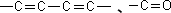
紫外吸収スペクトルはとても簡単である。キーワードは200nmであり、UVスペクトルで200nm以上に強い吸収が見られる化合物は分子内に共役系の構造を有する。
UVスペクトルは、下のように表れる。
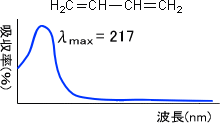
このようにUV吸収スペクトルはとても単純である。しかし、単純であるため共役系の有無以外は分からない。そのため、構造の決定などで紫外吸収スペクトルはほとんど行われていない。
装置
紫外部の測定には重水素放電管(D2ランプ)を使用し、可視部の測定にはタングステンランプやハロゲンランプを用いる。セルは紫外部の測定では石英製を使い、可視部の測定だけであればガラス製やプラスチック製でもよい。
スポンサードリンク
カテゴリー
スポンサードリンク
