相互作用の種類
相互作用には次のようなものがあります。
・ 共有結合
・ イオン結合
・ 双極子-双極子相互作用
・ 水素結合
・ ファンデルワールス力
・ 疎水性相互作用
共有結合
原子と原子がお互いに電子を出し合って結合しているのが共有結合です。共有結合は非常に強い結合です。
イオン結合
+の電荷をもつ物質と-の電荷をもつ物質はお互いを引き付ける力を持ちます。この力による結合がイオン結合です。
双極子-双極子相互作用
電気陰性度が異なる原子同士が結合していると、わずかであるが電荷に偏りを生じます。
例えば、H-O結合では酸素原子の方が電気陰性度が高いため、酸素原子が少しマイナスの電荷を帯び、水素原子が少しプラスの電荷を帯びることになります。
電気陰性度が強いということは電子を引き付ける力が強いということです。電子はマイナスの電荷を帯びているので、電気陰性度が強い酸素原子の方がマイナスの電荷を帯びるということが理解できます。
このような状態の分子を双極子といいます。
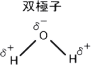
双極子では分子内でそれぞれ+、-の電荷を帯びているのでイオン結合の場合と同じように+-同士で引き合います。これによる結合を双極子-双極子相互作用といいます。
水素結合
水素結合は双極子-双極子相互作用の親戚のようなものです。水素-酸素、水素-窒素による結合は電気陰性度の違いが大きいので、それぞれ+-に偏る度合が大きのです。
そのため、双極子-双極子相互作用よりも強い結合となります。
ファンデルワールス力
全ての物質には引力が働いています。この力がファンデルワールス力であり、電気的に中性な分子間で働く弱い力です。
疎水性相互作用
水に溶けにくい性質を疎水性と言います。そして、水と疎水性物質である油を混ぜるとお互いに分離し、油は油同士で集まろうとします。これが疎水性相互作用です。
………………………………………………………………………………
それでは、これらの結合の中で重要な結合・重要でない結合はいったいどれでしょうか。
薬と受容体が結合するのに最も重要な相互作用には、次のようなものがあります。
・ 水素結合
・ ファンデルワールス力
逆にそれほど重要でない相互作用には次のようなものがあります。
・ 共有結合
・ イオン結合
なぜ共有結合やイオン結合の相互作用がそれほど重要でなく、水素結合やファンデルワールス力による相互作用が重要であるかですが、これはどの相互作用が薬と受容体との結合によく関わっているかによります。
つまり、共有結合やイオン結合によって薬と受容体が結合する相互作用は少なく、多くの薬は水素結合やファンデルワールス力によって受容体と結合するのです。 これが、水素結合やファンデルワールス力による相互作用が重要であるという理由です。
スポンサードリンク
カテゴリー
スポンサードリンク
