状態図、相図
相転移
相には気体、液体、固体があり、それぞれ気相、液相、固相という。物質がある相から他の相に変わることを相転移という。
固体が液体に変わる現象を融解といい、このときの温度が融点である。液体が気体に変わる現象が沸騰であり、この温度が沸点である。固体が液体にならずにそのまま気体になる現象が昇華であり、このときの温度が昇華点である。
下に水と二酸化炭素の圧力と温度によるおおまかな状態を示す。
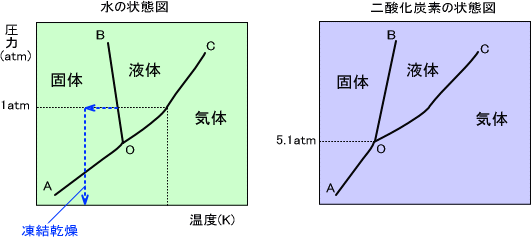
このような図を状態図という。曲線OCは蒸気圧曲線、曲線OBは融解曲線、曲線OAは昇華曲線を示している。固相、液相、気相の三相が互いに平衡となっているO点を三重点という。
凍結乾燥では物質を乾燥させたいとき、液体状態を飛ばすことで生体機能を損なわずに乾燥できる。温度を高くすることでの乾燥は、「高温による変性」などが起こる可能性がある。そこで、「温度を下げる→圧力を下げる」という作業によって物質を乾燥させることができる。
また、水と二酸化炭素の状態図で融解曲線の傾きが反対(正と負)になっているのはなぜか?であるが、これは二酸化炭素が凝固すると体積が減るのに対し、水が凝固すると体積が増えるからである。水の体積が最小になるのは4℃であり、水が氷になると体積が増えてしまう。
よく見られる状態図は二酸化炭素の方の状態図である。普通は液体よりも固体の状態の方が密度が大きい。密度が大きいため、圧力を高めると固体になりやすくなる。
スケートで滑るのにも、このことが関係している。乾いた氷では滑ることはできない。しかし、圧力がかかることで氷が溶け、滑ることでできるのである。
ところで、氷は水よりも密度が低い(氷の方が軽い)ことはとても重要なことである。もし、水よりも氷の方が密度が大きかったら氷の層は表面にはできず、水の底に溜まってしまう。すると、氷はなかなか溶けないため地球の温度は下がり、生命は誕生していないかもしれない。
相平衡
ギブスの相津は次のように表すことができる。
F = C - P + 2
ここでFはその系の自由度、Cはその系の成分の数、Pは系を構成する相の数である。自由度とは、その系の状態を表すのに必要な状態変数の数である。
もし、水やエタノールだけであるなら一成分なのでC=1である。しかし、水とエタノールを混ぜると二成分なのでC=2となる。また、水が固体、液体、気体の状態にあるときは相の数は1であるが融点、沸点、昇華点ではそれぞれ「固体と液体」「液体と気体」「固体と気体」の二つの状態で平衡になっているためP=2である。三重点ではP=3となり、このときの自由度Fを計算すると0になる。
一成分一相系の一番簡単な系では F = 1-1+2 = 2 となる。つまり、自由度Fは2である。状態変数には温度、圧力、組成、体積などがあり、この場合では「温度と圧力」「温度と体積」など、「二つの状態変数で系の状態を表すことができる」ということである。
・二成分系の気相-液相平衡
下に温度一定と圧力一定の場合の「二成分系の気相-液相平衡の相図」を示す。
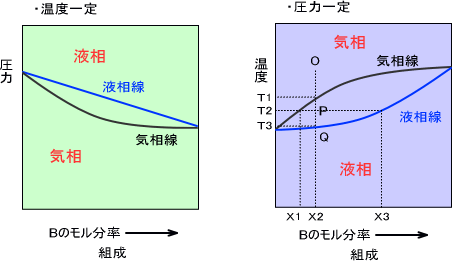
温度一定で圧力を変化させたとき、上の線を液相線と呼び下の線を気相線と呼ぶ。圧力一定で温度を変化させたとき、上の線が気相線で下の線が液相線である。
AとBの二成分があるとき、右の図で気相線より上には気相、気相線と液相線の間は気相と液相、液相線より下には液相が存在する。いま、B成分のモル分率がX2のときO点から冷却していくとする。すると、温度T1から液化が始まりT3になると完全に液化してしまう。
点Pでは蒸気相と溶液相の組成は蒸気相がX1、溶液相がX3となる。
「なぜ、温度一定のときと圧力一定のときで気相線と液相線の上下が逆になるか」であるが、これはよく考えれば簡単に理解できる。
圧力を高くすると物質は当然ながら圧縮される。圧縮されるということは分子どうしが近づき、密度が高まる。密度が高まるということは気体よりも液体になりやすいということである。つまり、圧力を高めると「気相→液相」となりやすくなる。これが、温度一定で圧力を変化させたとき、上の線を液相線と呼び下の線を気相線と呼ぶ理由である。
また、温度を高くしていくと物質は「固体→液体→気体」と変化していく。つまり、温度を高くしていくと「液相→気相」と変化する。このとき、上の線が気相線で下の線が液相線であると考えるのは当然のことである。
また、相図を見れば蒸留繰り返したときにどちらの成分の純物質に近づくかを理解できる。下に二硫化炭素-ベンゼン系の1atm下での相図(温度-組成図)を示す。
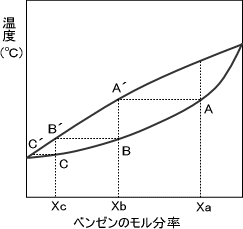
ベンゼンのモル分率がXaのとき、温度を上げるとA点で液相線にぶつかって沸騰を開始する。このときの蒸気相の組成はXbであり、蒸留によってベンゼンのモル分率がXbの溶液を得ることができる。つまり、それだけ二硫化炭素のモル分率が上がるのである。この作業を繰り返せば、最終的に溶液中に含まれるベンゼンのモル分率は0に近くなる。
二つの物質が共融混合物を作る場合は相図が少し異なり、下の図のようになる。
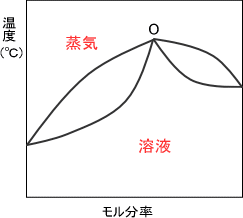
点Oでの組成では気相線と液相線が交わっており、蒸留によって分けることができない。また、混合物の組成比は外圧を加えない限り一定である。このような溶液を共融混合物という。なお、共融混合物は化合物ではない。
二成分系の固相-液相平衡
二つの物質を混合したときの固相-液相曲線は下の図のように表せられる。(共融混合物を形成する場合)
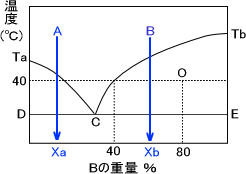
上の図でTa、Tbはそれぞれ物質A、物質Bの融点を示す。Bの組成がXaのとき、温度を下げていくとA線に沿って下がるようになる。Ta-C曲線との交点でAの結晶が析出し始め、直線DEに交わるとBの結晶が析出する。同じようにBの組成がXbで温度を下げると、Tb-C曲線との交点でBの結晶が析出し始める。
AとBの重量比が20:80で温度40℃における点Oでの「固相と液相の重量比」はてこの原理によって求めることができる。固相、液相の重量をそれぞれMa、Mbとすると次のように計算できる。
Mb×(80-40) = Ma×(100-80)
Ma:Mb = 2:1
よって、固相の重量:液相の重量は2:1である。また、液相のAとBの重量比はBの重量比が40%のため、Aの重量比が60%となる。
分子化合物を作る場合、相図はより複雑になる。下にベンゾフェノン-ジフェニルアミンの二成分系の相図を示す。
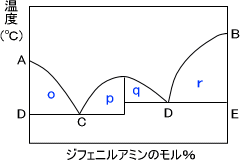
ベンゾフェノンを 、ジフェニルアミンを
、ジフェニルアミンを とすると、oの部分では固体の
とすると、oの部分では固体の と液体の
と液体の 、
、 が混合している状態にある。p、qでは固体の
が混合している状態にある。p、qでは固体の 、
、 の分子化合物と液体の
の分子化合物と液体の 、
、 が存在する。rでは固体の
が存在する。rでは固体の と液体の
と液体の 、
、 が存在している。
が存在している。
なお、点Dでは 、
、 の分子化合物の共融混合物の結晶が生じる。
の分子化合物の共融混合物の結晶が生じる。
スポンサードリンク
カテゴリー
スポンサードリンク
