sp3,sp2,sp混成軌道の見分け方とヒュッケル則
手の数で見分ける混成軌道
混成軌道にはそれぞれsp3混成軌道、sp2混成軌道、sp混成軌道が存在する。これらを見分けるのは簡単であり、「何本の手があるか」というのを考えれば良い。下にそれぞれの混成軌道を示す。
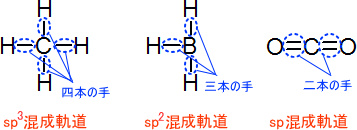
CH4に注目すると、C(炭素)の原子からは四つの手が伸び、それぞれ共有結合している。このように、「四つの手をもつ場合はsp3混成軌道」と考えれば良い。
また、BH3に着目すると、B(ボラン)の原子からは三つの手が伸びている。そのため、BH3は「三つの手をもっているのでsp2混成軌道」と考えることができる。
同じように考えて、CO2は「二本の手をもつのでsp混成軌道」となる。
sp3混成軌道 |
sp2混成軌道 |
sp混成軌道 |
四本の手 |
三本の手 |
二本の手 |
このように考えれば、ベンズアルデヒドやカルボカチオンの混成軌道を簡単に予測することができる。なお、ベンズアルデヒドとカルボカチオンの炭素原子は全てsp2混成軌道となる。
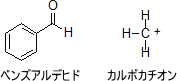
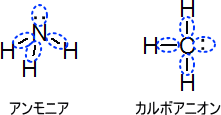
ただし、非共有電子対も一つの手として考える。つまり、NH3(アンモニア)やカルボアニオンはsp2混成軌道ではなく、sp3混成軌道となる。
なお、この法則にも例外がある。それは、ヒュッケル則を説明した後に述べようと思う。
ヒュッケル則
化合物が芳香族性を示すのにはある条件がいる。
・環構成原子が全てsp2軌道
・環中のπ電子の数が「4n+2」を満たす
このように芳香族性の条件としてπ電子が「4n 2」を満たすことが挙げられ、これをヒュッケル則 (Huckel則)という。ヒュッケル則は実際にπ電子の数を数えて見れば、簡単に理解できる。それでは、ベンゼン環のπ電子の数を数えてみようと思う。
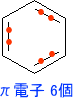
ベンゼンはπ電子を6個もつ。そのため、ヒュッケル則はを満たす。ただし、ピロールやフランでは少し問題が出てくる。ベンゼン環と同じようにπ電子の数を数えたら、π電子が4個しかないのである。
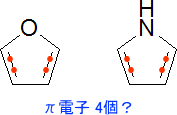
このままでは芳香族性を示せないので、それぞれO (酸素原子)やN (窒素原子)の非共有電子対をπ電子として借りるのである。これによってπ電子が6個になり、ヒュッケル則を満たすようになる。
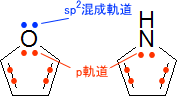
そのため、ピロールのNの非共有電子対はp軌道に収容されて芳香族性に関与する。また、フランのOの一方の非共有電子対はp軌道で芳香族性に寄与し、もう一方の非共有電子対はsp2混成軌道となる。
このフランやピロールの例が、「手の数によって混成軌道を見分けることができる」の例外である。
より詳しい混成軌道
手の数によって混成軌道を見分ける話をしたが、本当は「分子がどのような形をしているか」によって混成軌道が決まる。sp3混成では分子の結合角が109.5°、sp2混成軌道では結合角が120°、sp混成軌道では結合角が180°となっている。
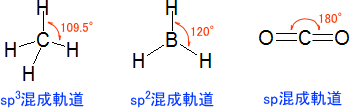
電子は-(マイナス)の電荷を帯びており、お互いに反発する。そのため、それぞれの電子対は最も離れた位置に行こうとする。メタンの場合は共有電子対が四組あり、四つが最も離れた位置になるためには結合角が109.5°となる必要がある。
ボランでは共有電子対が三つあり、それぞれ結合角が120°で最も離れた位置となる。二酸化炭素ではお互いに反対の位置の180°となる。
「アンモニアはsp3混成軌道である」と説明したが、これは三つの共有電子対に一つの非共有電子対をもつからである。合計四つの電子対が存在するため、四つが離れた位置となるためにはsp3混成軌道の形をとるであろうと容易に想像することができる。
アンモニアの結合角は107.5°であり、sp2混成軌道の120°よりもsp3混成軌道の109.5°に近い。ただし、アンモニアの結合角は109.5°でないため、厳密に言えば「アンモニアはsp3混成軌道である」と言うことはできない。
スポンサードリンク
カテゴリー
スポンサードリンク
